Optische Kohärenztomographie
Die optische Kohärenztomographie (auch optische Kohärenztomografie, englisch optical coherence tomography, kurz OCT) ist ein bildgebendes Verfahren, um 2- und 3-dimensionale Aufnahmen aus streuenden Materialien (beispielsweise biologischem Gewebe) in Mikrometerauflösung zu erhalten.

Dazu wird breitbandiges Licht von zeitlich geringer Kohärenzlänge in einem Strahlteiler in zwei Teile geteilt. Ein Teil wird auf die Probe gelenkt. Der andere Teil durchläuft eine Referenzstrecke. Das von der Probe reflektierte Licht wird mit dem Referenzlicht in einem Interferometer überlagert und so zur Interferenz gebracht. Aus dem Interferenzsignal lassen sich dann verschiedene Strukturen entlang der optischen Achse (Tiefe) unterscheiden. Durch laterales Scannen über die Probe erhält man dreidimensionale Bilder.
OCT ist analog zur Sonografie, nur dass es Licht anstelle von Schall verwendet.
Haupteinsatzgebiet der OCT ist die Medizin, primär die Augenheilkunde. Hier wird in der Regel Infrarotlicht im Wellenlängenbereich von ca. 800 bis 1400 nm benutzt (daher auch die Bezeichnung als optische Tomografie).
Die Stärken der OCT liegen in der relativ hohen Eindringtiefe (1–3 mm, abhängig von den verwendeten Wellenlängen) in streuendes Gewebe bei gleichzeitig hoher axialer Auflösung (0,5–15 µm). Die Bandbreite der verwendeten Lichtquelle bestimmt die axiale Auflösung. Beispiel: eine Superlumineszenzdiode als Lichtquelle mit einer zentralen Wellenlänge von 1325 nm und einer Bandbreite von 97 nm hat eine Kohärenzlänge von ca. 16 Mikrometer. Die OCT-Auflösung in axialer Richtung ist dann gleich der halben Kohärenzlänge, im Beispiel somit 8 Mikrometer.
Um ein vollständiges 3D-Bild zu erhalten, sind je nach OCT-Messmethode Scans über das Objekt zu machen. Soll beispielsweise ein Volumen von 1 mm × 1 mm × 1 mm mit einer Auflösung in alle Richtungen von 10 Mikrometern gescannt werden, braucht man dazu im ungünstigsten Fall 1 Million Messungen. Je nach verwendeter OCT-Messmethode kann jedoch beispielsweise die axiale Messung simultan über die ganze Tiefe erfolgen. Dann werden für das Vermessen eines 1 mm × 1 mm × 1 mm Volumens mit 10 Mikrometern Auflösung nur noch 10.000 Scans entsprechend 10.000 Messungen benötigt. Kommerzielle OCT-Instrumente (Stand 2019) erreichen Scanraten von 85 kHz[1].
Prinzip
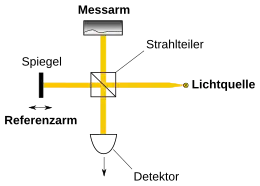
„Das Prinzip der OCT beruht auf der Technik der Weißlicht-Interferometrie, welche Strahlung mit geringer zeitlicher Kohärenz einsetzt und sich am technischen Aufbau eines Michelson-Interferometers darstellen lässt“.[2]
Eine Lichtquelle (beispielsweise eine Superlumineszenzdiode) beleuchtet über einen Strahlteiler die zu untersuchende Probe im Messarm (Probenstrahl) des Weißlichtinterferometers. Das vom Strahlteiler durchgelassene Licht (Referenzstrahl) fällt auf einen Spiegel im Referenzarm und wird von diesem zurückreflektiert. Probenstrahl und Referenzstrahl treffen wieder zusammen und interferieren genau dann, wenn die Differenz der von beiden Strahlen zurückgelegten Wege kleiner als die Kohärenzlänge ist. Das Interferenzsignal wird mit einem Detektor aufgezeichnet und danach ausgewertet. Indem der Spiegel im Referenzarm verfahren wird, erhält man Interferenzsignale aus unterschiedlichen Tiefen der Probe, wenn es dort reflektierende Strukturen gibt. Das Verfahren des Spiegels im Referenzarm bei gleichzeitiger Messung des Interferenzsignals erlaubt somit ein axiales Scannen der Probe. Da Weglängenunterschiede über die Lichtgeschwindigkeit auch als Laufzeitdifferenzen angegeben werden können, wird diese OCT-Methode als Time-Domain (TD) OCT bezeichnet. Um ein 3-dimensionales Bild der Probe zu erhalten, wird der Probenstrahl lateral über die Probe gefahren (gescannt). Die kleinstmögliche laterale Auflösung entspricht in diesem Fall etwa dem Durchmesser des Lichtstrahls. Die axiale Tiefenauflösung wird dagegen durch die Koheränzlänge des verwendeten Lichts bestimmt.
Anwendung
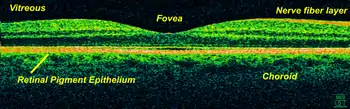
Anwendungsbereiche liegen primär in der Medizin: Vor allem in der Augenheilkunde sowie zur frühzeitigen Krebsdiagnose und zur Hautuntersuchung wird die OCT eingesetzt. Hier werden Reflexionen an Grenzflächen von Materialien mit unterschiedlichem Brechungsindex ausgemessen und so ein dreidimensionales Bild rekonstruiert. Eine solche Rekonstruktion wird als Tomografie bezeichnet.
Verwendet wird OCT derzeit bei der Untersuchung des Augenhintergrundes bzw. des hinteren Augenabschnittes, da konkurrierende Techniken wie z. B. das Konfokalmikroskop die feine Schichtstruktur der ca. 250–300 µm dicken Netzhaut aufgrund der geringen Pupillengröße und des großen Abstandes von Hornhaut zur Netzhaut nur unzureichend abbilden können. Weiterhin wird mit OCT bei Voruntersuchungen für Kataraktoperationen die Augenlänge gemessen. Dies ist ein wichtiger Parameter zur Berechnung der einzusetzenden Intraokularlinse. Andere Verfahren wiederum eignen sich nicht aufgrund ihrer hohen Belastung des menschlichen Auges bzw. werden vom Glaskörper des Auges zu stark beeinträchtigt (z. B. hochauflösender Ultraschall). Außerdem ist das berührungslose Messen von Vorteil, weil Infektionsrisiken und psychische Belastung weitgehend reduziert werden.
Die OCT-Untersuchung der Netzhaut dient der Diagnostik von Erkrankungen der Netzhaut wie der Makuladegeneration (Erkrankung der zentralen Netzhaut), des diabetischen Makulaödems (Flüssigkeitseinlagerung in die zentrale Netzhaut bei der Diabetischen Retinopathie) und des Makulaödems bei Netzhautvenenthrombose (Zentralvenenthrombose, Astvenenthrombose). Ferner wird die Untersuchung einzelner Netzhautschichten wie der retinalen Nervenfaserschicht (retinal nerve fiber layer, RNFL) und des Ganglienzellkomplexes (ganglion cell complex, GCC) zur Diagnostik von Erkrankungen des Sehnerven, etwa der Optikusatrophie, oder beim Glaukom herangezogen. Wegen ihrer Bedeutung ist die OCT-Untersuchung in der Augenheilkunde Facharztstandard (Behandlungsstandard eines durchschnittlichen Facharztes für Augenheilkunde). Die in Deutschland verwendeten OCT-Geräte in Augenarztpraxen sind aber durchaus unterschiedlich.[3]
Eine weitere Anwendung der OCT in der Augenheilkunde ist die OCT-Angiografie. Um den Blutfluss mittels OCT-Angiografie abzubilden, wird zunächst jeder B-Scan eines Volumenscans an der exakt gleichen Position mehrfach kurz hintereinander wiederholt, und die zeitlichen Kontrastunterschiede an dieser Position werden analysiert. Aus der vergleichenden Auswertung aller B-Scans eines Volumenscans ergeben sich neben Bereichen mit gleichbleibendem Kontrast auch Bereiche mit zeitlichen Kontrastunterschieden. Diese stellen einen Blutfluss dar, sodass das Gefäßsystem mittels OCT-Angiografie innerhalb des vom Volumenscan erfassten Bereichs dreidimensional dargestellt werden kann. Durch Segmentierung zwischen bestimmten Netzhautschichten können zudem partielle En-face-Darstellungen des Mikrogefäßsystems dieser Netzhautbereiche in beliebiger Tiefe erstellt werden.[4] Dies kann unter anderem angewandt werden um die Flussdichte in der Choriocapillaris zu untersuchen.[5][6] Diese Gefäßschicht ist ansonsten nur schwer darstellbar.
Neben der diagnostischen Bildgebung, findet die OCT inzwischen auch intraoperativ Anwendung. Beispielsweise bei Netzhautoperationen lässt sich so 'live' eine epiretinale Membran darstellen.[7][8] Ob dies zu besseren operativen Ergebnissen führt ist bislang jedoch unklar.
Ein neues Einsatzgebiet der OCT ist die kardiovaskuläre Bildgebung.[9] Die intravaskuläre optische Kohärenztomographie ist eine neue, auf Infrarotlicht basierende Technik, die Arterien mit einer Auflösung von 10–20 µm darstellen kann. Verschiedene präklinische sowie klinische Serien zeigten, dass OCT eine sichere Identifikation intramuraler sowie luminaler Morphologien ermöglicht, z.B. Plaques, Thromben, Dissektionen sowie Informationen über Lumen und Stentdimensionen. Studien zum Vergleich von IVUS und OCT zeigten, dass OCT zusätzliche morphologische Informationen erbringt, die eine verbesserte Plaquecharakterisierung erlauben.[10]
Die OCT hat ein sehr großes, weiterhin wachsendes Anwendungspotential im Bereich der zerstörungsfreien Prüfung. Weltweit arbeiten einige Gruppen daran, die OCT auch für die Qualitätskontrolle von Produkten und Prozessen in der Industrie zu etablieren. Vor allem im Bereich der Kunststoffindustrie gibt es ein breites Anwendungsspektrum (z. B. die Inline-Überwachung von Extrusionsprozessen, Qualitätskontrolle von Verbundmaterialien etc.). Ein weiterer Anwendungsbereich mit großem Zukunftspotential (aufgrund der hohen Stückzahlen / Durchsätze) ist die Überwachung von Tablettenbeschichtungsprozessen in der pharmazeutischen Industrie.[11]
Axiale Auflösung und Bandbreite
Nach anfänglichen Versuchen mit Lichtquellen beschränkter Bandbreite (einige Nanometer) wurden relativ breitbandige Lichtquellen mit hoher räumlicher Kohärenz verfügbar und eingesetzt. Zumeist basierten die Systeme auf Superlumineszenzdioden mit einigen zehn Nanometer Bandbreite (typ. 30 nm, entspricht mindestens 30 µm Auflösung.). Im Jahre 1997 wurde diese Auflösung um das Zehnfache gesteigert (>100 nm, entspricht mindestens 3 µm axialer Auflösung). Damit kommen die Tomogramme den histologischen Schnitten sehr nah (1 µm Schnittdicke).

Folgende Formel (hergeleitet aus dem Fourierverhältnis zwischen Korrelationsbreite und spektraler Breite, gemessen bei voller Breite auf halber Höhe) erlaubt es, bei einem Spektrum mit Gauß-Verteilung die zugehörige axiale Auflösung zu berechnen:
- = axiale Auflösung
- = zentrale Wellenlänge
- = volle spektrale Bandbreite bei halber Höhe des Spektrums (FWHM) Annahme: gaußförmiges Spektrum
Die Dispersion im menschlichen Gewebe und vor allem im Glaskörper des Auges zerstört die Kohärenz der beiden Arme. Geschicktes Ausbalancieren der Dispersion in beiden Armen ermöglicht aber ein Restituieren der Kohärenz. Die Präzision der ultrahochauflösenden OCT hat zu einem Umdenken in der Augenheilkunde geführt, da Augenärzte plötzlich Informationen erhalten können, die sie nur aus dem Lehrbuch kannten. Dies ermöglicht, bereits kleinste Veränderungen in Frühstadien zu erkennen, was mit anderen Methoden nur schwer oder gar nicht möglich war.
Neueste Entwicklungen der nichtlinearen Optik erlauben es, Lichtquellen für andere Wellenlängenregionen und mit noch größerer Bandbreite zu entwickeln (siehe Bild).
Abtastrate
Im Zeitbereich wird das Interferenzsignal auf beliebig kleinen Intervallen abgetastet (engl. sampled). Die Abtastrate hat allerdings keinen Einfluss auf die Auflösung. Die Kurve wird deshalb zwar genauer gemessen, die geringste Breite eines Einzelsignals wird aber nicht schmaler. Unterschreitet die Abtastrate allerdings die doppelte Trägerfrequenz des Signals, kommt es zu Aliasing-Artefakten gemäß dem Abtasttheorem von Nyquist-Shannon.
Messmethoden

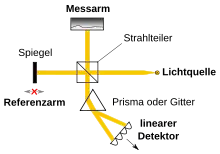
Aufgrund der Verknüpfung der Autokorrelation (Kreuzkorrelation eines zeitlichen Signales mit sich selbst) mit dem Frequenzspektrum einer Funktion über die Fourier-Transformation gilt im optischen Bereich die analoge Beziehung zwischen dem optischen Spektrum und dem Interferenzsignal. Deshalb spricht man einerseits vom Signal im Zeitbereich (englisch time domain, TD) und andererseits vom Signal im Frequenzbereich (englisch frequency domain, FD). Einfach ausgedrückt bedeutet dies, dass man entweder den Referenzarm in der Länge verändert und kontinuierlich die Intensität der Interferenz misst, ohne auf das Spektrum Rücksicht zu nehmen (time domain), oder die Interferenz der einzelnen spektralen Komponenten erfasst (frequency domain). Eine Variante des FD-OCT nimmt die einzelnen spektralen Komponenten zeitlich nacheinander auf, indem die Wellenlänge der Strahlungsquelle durchgestimmt wird (englisch swept source, SS). SS-OCT kommt deshalb ohne Spektrometer bei der Detektion aus, benötigt aber eine hinsichtlich der Wellenlänge durchstimmbare Strahlungsquelle. FD-OCT wurden erst durch die Verfügbarkeit von schnellen, empfindlichen Kameras und schnellen Rechnern ermöglicht.
Der Vorteil der FD-Verfahren liegt in der einfachen und schnellen simultanen Messung. Hier kann simultan die vollständige Information über die Tiefe akquiriert werden, ohne ein mechanisch bewegliches Teil zu benötigen. Dies erhöht die Stabilität und die Geschwindigkeit. Man kann den Unterschied der Verfahren auch darin sehen, dass TD-OCT in jedem Messpunkt die Gesamtleistung des Referenz- und des Messarmes aufnehmen muss, dabei aber der Interferenzanteil nur einen extrem kleinen Teil ausmacht, wodurch das Rauschen des Gesamtsignals gegenüber dem Nutzanteil überwiegt. Bei Aufnahme im Frequenzbereich (FD-OCT) wird in jedem spektralen Kanal nur die entsprechende spektrale Leistung als Hintergrund gemessen. Somit gehen alle Störungen aus den anderen spektralen Bereichen verloren. Die notwendige Dynamik des Detektors sinkt mit der Gesamtleistung pro Kanal. Folglich benötigen bei gleicher Sensitivität (= Empfindlichkeit zur Messung kleinster Reflektivitäten) Frequenzbereichsmessungen nur einen Bruchteil der Strahlungsleistung. FD-OCT ist weitaus effektiver als TD-OCT.[12] Für Anwendungen am Auge kann dies ein wichtiger Aspekt sein. Prinzipiell ist auch im Zeitbereich das Analoge zur SS-OCT, d. h. eine simultane Messung möglich, sie erfordert aber nichtlineare Prozesse, die nur bei relativ hohen Lichtintensitäten funktionieren. Dies widerspricht aber der hochsensitiven Messung bei Messsignalleistungen unterhalb des Nanowattbereichs.
Die Fourier-Transformation arbeitet allerdings im komplexen Zahlenraum, deshalb sind beide Verfahren nur dann gleichwertig, wenn die komplexwertigen Funktionen bekannt sind. Das endgültige Messsignal soll aber den zeitlichen Verlauf der Reflektivität (= Absolutbetrag der Intensität in der Zeit). wiedergeben, weshalb es bei Intensitätsaufnahmen im Frequenzbereich und dem Fehlen der komplexwertigen Information zu Doppeldeutigkeiten kommt. Das Ergebnis ist das „Umklappen des Bildes“ beim konventionellen FD-Verfahren. Da der imaginäre Anteil einer Funktion aber einem Phasensprung um 90° entspricht, kann man durch zusätzliche Messung mit einem um 90° in der Laufzeit (also einem Viertel der Wellenlänge) verschobenen Referenzarm die komplexwertige Funktion herstellen und damit die vollständige zeitliche Funktion rekonstruieren.
Abtastrate, Linienbreite und Messtiefe
Die Abtastrate im Frequenzbereich ist über die Fourier-Transformation mit der Messtiefe verknüpft. Eine höhere Abtastrate bzw. Pixelanzahl eines Detektors innerhalb des gleichen Spektralbereiches erhöht also den Bereich, in dem mehrere Objekte eindeutig voneinander unterschieden werden können. Hier gilt aber wieder dieselbe Einschränkung wie im Zeitbereich: Wenn die Linienbreite, also die geringst mögliche spektrale Einzellinie unterschritten wird, gibt es keine zusätzliche Information beim Überabtasten mehr. (Die Linienbreite ist entweder durch die Lichtquelle beim temporal encoding oder durch die Abbildungsgeometrie und Streueffekte im Spektrometer beim spatial encoding beschränkt). Eine größere Linienbreite als Abtastdichte führt nach der Fourier-Transformation zu einem Abfall der Objektintensität gegen den Rand des Ortsraumes. Beim Unterabtasten wiederum kommt es zur Ausbildung von Mehrfachbildern auch abseits der nullten Ordnung des Ortsbereichs, also dem Bereich, in dessen Mitte der Messarm und der Referenzarm gleich lang sind. Beim Unterabtasten werden folglich Objekte außerhalb des Messbereichs hereingespiegelt.
OCT-Messmethoden
In der letzten Zeit wurden viele unterschiedliche Methoden zur Signalerfassung entwickelt – im Folgenden ein systematischer Überblick über alle möglichen Verfahren. Die holografischen Verfahren sind das räumliche, transversale Pendant zum longitudinalen, zeitlichen Frequenzbereich der optischen Laufzeit. Es besteht also eine Fourier-Beziehung zwischen longitudinaler Laufzeit und zeitlicher Frequenz sowie zwischen transversaler Auslenkung und transversaler Ortsfrequenz. Prinzipiell unterscheidet man zwei Untergruppen, bei denen einerseits das Signal zeitlich kodiert wird (time encoded), also sequentiell aufgenommen wird, oder räumlich kodiert (spatially encoded), also räumlich aufgespalten, aber simultan aufgezeichnet wird. Oft werden unsystematische Bezeichnungen wie „Fourier Domain OCT“ oder „Spectral OCT“ verwendet, die aber meist verwirrend (Verwechslung mit spectroscopic OCT) und ungenau (die Frequenz steht mit der Zeit in Korrelation, nicht die Wellenlänge) oder manchmal sinnentleert sind (es existiert kein Fourier-Bereich). Sie sind in der Tabelle unten dennoch zur Orientierung als alternative Bezeichnungen angegeben.
| Time Domain (TD) | Frequency Domain (FD) | ||||
|---|---|---|---|---|---|
| Tiefenscan | sequentiell | simultan | sequentiell | simultan | |
| Aufwand | mechanisch hoch | elektronisch + optisch hoch | optisch + Nachverarbeitung hoch | optisch + Nachverarbeitung hoch | |
| Lichtquelle | breitbandig | breitbandig | veränderliche Wellenlänge | breitbandig | |
| Interferometer | Strahlteiler | aufgeweiteter Messstrahl | Strahlteiler | Strahlteiler | |
| Scanner | verschiebbarer Referenzarmspiegel | statisch | statisch | statisch | |
| Detektor | einfach, hochempfindlich (Diode) | Feld (Dioden, CCD oder CMOS line-array) | einfach, hochempfindlich (Diode) | komplex, Prisma oder Gitter + Feld | |
| 1D-OCT | |||||
| systematische Bezeichnung | 1D-teTD OCT | 1D-seTD OCT | 1D-teFD OCT | 1D-seFD OCT | |
| alternative Bezeichnung | scanning TD OCT | – | swept source OCT, spectral Domain OCT | Frequency Domain OCT, Fourier (Transform) OCT, spectral Domain OCT | |
| 2D-OCT | |||||
| systematische Bezeichnung | 2D-teTD OCT | 2D-seTD OCT | 2D-teFD OCT | 2D-seFD OCT | |
| alternative Bezeichnung | – | – | – | parallel spectral Domain OCT | |
| Parallelisierbarkeit | einfach | mittel | einfach | schwer | |
| 2D-Orientierung | en-face (normal zum Strahl) | Querschnitt (eine Achse in Strahlrichtung) | en-face | Querschnitt | |
| 3D-OCT | |||||
| systematische Bezeichnung | 3D-teTD OCT | 3D-seTD OCT | 3D-teFD OCT | 3D-seFD OCT | |
| alternative Bezeichnung | en-face OCT, full field/frame OCT | – | time encoded Frequency Domain OCT | – | |
| Parallelisierbarkeit | einfach | – | einfach | extrem komplex | |
| Holografische Abbildung | |||||
| systematische Bezeichnung | holo-teTD-OCT | – | holo-teFD-OCT | – | |
| alternative Bezeichnung | holographic OCT | – | holographic teFD OCT | – | |
Die Verfahren unterscheiden sich in ihrer Abbildungsqualität und Anwendbarkeit, bedingt durch die Verwendung verschiedener Komponenten. Speziell die FD-Verfahren haben den Vorteil, kein Licht zu vergeuden, und besitzen eine vielfach höhere Empfindlichkeit. Das Ziel ist eine hohe Sensitivität bei Einsatz möglichst weniger beweglicher Komponenten und damit eine hohe Geschwindigkeit, beispielsweise 3D-teFD- und holografische Verfahren. Andererseits ist die Phasenkohärenz besser bei den potenziell langsameren Verfahren. Darüber hinaus kommt es auf die Ausrichtung der Rastermethode und deren Rasterdichte an; so wird in geschichteten biologischen Geweben üblicherweise eine hohe Rasterdichte im Tiefenquerschnitt gewünscht, die von den schnellen, einfachen On-face-Methoden nur schwer geliefert wird.
Erweiterungen
Zusätzlich zur rein topografischen Information können weitere Daten aus dem Ursprungssignal ausgewertet werden. So kann über Messung mehrerer aufeinanderfolgender Tomogramme an der gleichen Stelle die lokale Dopplerverschiebung zur Geschwindigkeitsmessung herangezogen werden (Doppler-OCT). Darüber hinaus können verschiedene Materialeigenschaften wie Streuung, Absorption, Polarisationveränderung (englisch polarisation sensitive OCT) und Dispersion ermittelt und dargestellt werden. Darüber hinaus versucht man, Gewebe zu markieren oder nur selektiv nach bestimmten Molekülen zu durchsuchen (englisch molecular contrast OCT).
Vorteile
Der große technologische Vorteil der OCT ist die Entkopplung der Tiefenauflösung von der transversalen Auflösung. Die rein auf optischer Reflexion basierende und damit berührungslose Messung erlaubt den Wegfall der in der Mikroskopie angewandten Dünnschnitte, wodurch das Verfahren mikroskopische Bilder im lebenden Gewebe (in vivo) erlaubt.
Aufgrund der hohen Selektivität des Wirkungsprinzipes können sehr kleine Signale (unterhalb von Nanowatt) detektiert und einer bestimmten Tiefe zugeordnet werden, bei geringen Eingangsleistungen. Damit eignet sich dieses Verfahren auch gut, um lichtempfindliche Gewebe zu untersuchen.
Der Einsatz von OCT wird durch die wellenlängenabhängige Eindringtiefe elektromagnetischer Strahlung in das Untersuchungsobjekt sowie durch die bandbreitenabhängige Auflösung beschränkt. Hochentwickelte Breitband-Laser ermöglichen seit 1996[13] die Entwicklung der UHR-OCT (ultra-high resolution OCT), die die Tiefenauflösung von mehreren Mikrometern bis zu Bruchteilen von Mikrometern vorangetrieben hat. Subzelluläre Strukturen in menschlichen Krebszellen können auf diese Weise dargestellt werden.
Ähnliche Verfahren
OCT ist verwandt mit anderen interferometrischen profilgebenden Verfahren (die allerdings nur Oberflächen messen können) wie der Holografie und dem optischen Kohärenzradar, das zur hochpräzisen dreidimensionalen Darstellung von Oberflächen im Flugzeugbau und der Autoindustrie dient.
Außerdem überlappt die digitale Holografie mit dem Bereich der OCT. Hier wird das physikalische Bild in der Fourierebene aufgenommen und das Interferenzmuster mittels mathematischer Rückrechnung auf das gesamte Volumen erweitert. Der Vorteil hier ist die Unabhängigkeit von der Fokussierung (die numerisch kompensiert wird), die nur einen Abfall in der Intensität, aber keine Unschärfe bewirkt. Numerische Holografie hat den Nachteil, dass sie sehr empfindlich bezüglich Speckle und mehrfach gestreuten Photonen ist, die bei streuenden Materialien vermehrt auftreten. Zudem kann die Holografie, so wie die „Full-Field“-OCT-Varianten, nicht von dem konfokalen Vorteil zur Unterdrückung des Übersprechens profitieren. Überlappung gibt es auch bei den Phasenmodulationsverfahren, bei denen primär die Phase im Interferenzarm moduliert wird. Eine Alternative zu OCT in der Medizin ist die Multiphotonen-Tomografie, die höhere Auflösungen ermöglicht, jedoch ist die Signaltiefe auf mehrere hundert Mikrometer begrenzt.
Ausblick
OCT ist ein relativ junges Verfahren (Erstentwicklung in den späten 1980er Jahren) und beginnt sich derzeit auf verschiedenen Gebieten zu etablieren. Auch sind noch nicht alle technischen Möglichkeiten ausgeschöpft. Die geringe Belastung des Untersuchungsobjekts, die hohe Auflösung und zunehmende Geschwindigkeit machen das Verfahren sehr attraktiv. Neue Lichtquellen, Detektoren und Scanner werden es künftig erlauben, hochaufgelöste dreidimensionale Mikroskopie am lebenden Gewebe in Videogeschwindigkeit durchzuführen. Die Datenmenge für solche Aufnahmen hoher Qualität würde einige Gigavoxel pro Sekunde erreichen; derzeitige hochauflösende OCT-Verfahren erreichen bis zu 250 Megavoxel pro Sekunde, wobei der Stand im Jahre 2000 noch unterhalb von 100 Kilovoxel pro Sekunde lag. Ultrahochgeschwindigkeits-OCT mit geringerer Empfindlichkeit erreicht durch parallele Detektion bereits bis zu 60 Gigavoxel pro Sekunde.
Einzelnachweise
- SPECTRALIS OCT2 Modul. In: Herstellerwebsite zum SPECTRALIS OCT Gerät. Heidelberg Engineering GmbH, abgerufen am 5. November 2019.
- Cyriak Nathanael Schulz-Wackerbarth: Evaluation der Spaltlampen Spectral Radar Optischen Kohärenztomographie (SL SR OCT) und Vergleich mit SL OCT und Stratus OCT bei physiologischen und pathologischen Befunden des vorderen und hinteren Augenabschnittes. Dissertation, Lübeck 2011, https://www.zhb.uni-luebeck.de/epubs/ediss1019.pdf.
- Qualitätssicherung der optischen Kohärenztomografie für die Diagnostik des Augenhintergrunds. (PDF) Abgerufen am 28. Januar 2019.
- G. E. Lang, C. Enders, J. U. Werner: [New Possibilities in Retinal Diagnostics Using OCT Angiography]. In: Klinische Monatsblätter für Augenheilkunde. Band 233, Nr. 5, Mai 2016, ISSN 1439-3999, S. 613–621, doi:10.1055/s-0042-105325, PMID 27187882.
- Al-Sheikh M, Falavarjani KG, Pfau M, Uji A, Le PP, Sadda SR: Quantitative Features of the Choriocapillaris in Healthy Individuals Using Swept-Source Optical Coherence Tomography Angiography. In: Ophthalmic Surg Lasers Imaging Retina. 48, Nr. 8, August 2017, S. 623–631. doi:10.3928/23258160-20170802-04. PMID 28810037.
- Wintergerst MWM, Pfau M, Müller PL, Berger M, de Sisternes L, Holz FG, Finger RP: Optical Coherence Tomography Angiography in Intermediate Uveitis. In: Am J Ophthalmol. 194, Oktober 2018, S. 35–45. doi:10.1016/j.ajo.2018.06.023. PMID 30026083.
- Pfau M, Michels S, Binder S, Becker MD: Clinical Experience With the First Commercially Available Intraoperative Optical Coherence Tomography System. In: Ophthalmic Surg Lasers Imaging Retina. 46, Nr. 10, 2015, S. 1001–8. doi:10.3928/23258160-20151027-03. PMID 26599241.
- Neuhann R, Neuhann T, Hörster R, Cursiefen C, Guell J, Siebelmann S: Laser-integrated Real-Time Optical Coherence Tomography (LI-OCT) in Anterior Segment Procedures. In: J Cataract Refract Surg. August 2021. doi:10.1097/j.jcrs.0000000000000773. PMID 34393183.
- Optische Kohärenztomographie (OCT), Medizinische Klinik für Kardiologie (CBF) an der Charité. Abgerufen am 22. November 2018.
- OCT – Intrakoronare Bildgebung, Klinikum der Universität München. Abgerufen am 22. November 2018.
- D. Markl u. a.: Optical coherence tomography as a novel tool for in-line monitoring of a pharmaceutical film-coating process. In: European Journal of Pharmaceutical Sciences., 55, 2014, S. 58–67, doi:10.1016/j.ejps.2014.01.011.
- Bin Liu, Mark E. Brezinski: Theoretical and practical considerations on detection performance of time domain, Fourier domain, and swept source optical coherence tomography. In: Journal of Biomedical Optics. Band 12, 2007, ISSN 1083-3668, S. 044007, doi:10.1117/1.2753410.
- Wolfgang Drexler u. a.: Ultrahigh-resolution ophthalmic optical coherence tomography. In: Nature Medicine. Band 7, Nr. 4, 2001, S. 502–507, doi:10.1038/86589 (Erratum. In: Nature Medicine. Band 7, Nr. 5, 2001, S. 636).