Nitrylfluorid
Nitrylfluorid ist eine chemische Verbindung aus der Gruppe der Nitrylverbindungen und Fluoride. Sie wurde 1905 zuerst von Henri Moissan synthetisiert und 1929 durch Otto Ruff erstmals untersucht.[3]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Nitrylfluorid | |||||||||||||||
| Summenformel | NO2F | |||||||||||||||
| Kurzbeschreibung |
farbloses Gas mit stechendem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 65,00 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig[1] | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
−72,6 °C[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Nitrylfluorid kann durch eine zweistufige Reaktion gewonnen werden. Zuerst wird eine Lösung von Distickstoffpentoxid in Nitromethan mit Bortrifluorid und Fluorwasserstoff zu Nitrylfluorborat umgesetzt. Dieses reagiert bei 240 °C mit Natriumfluorid zu Nitrylfluorid.[1]
Auch eine direkte Reaktion von Distickstoffpentoxid mit Natriumfluorid ist möglich.[4]
Ebenfalls möglich ist die Darstellung durch Reaktion von Stickstoffdioxid mit Fluor.
Eigenschaften
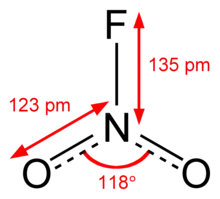
Nitrylfluorid ist eine als Gas und als Flüssigkeit farblose, im festen Zustand weiße, stechend riechende Verbindung, die von Wasser hydrolysiert wird. Es reagiert mit den meisten Metallen und Nichtmetallen, sowie heftig mit Ethanol, Ether, Benzol und Chloroform.[1]
Verwendung
Nitrylfluorid wird als Fluorierungs- und Oxidationsmittel verwendet.[3]
Einzelnachweise
- Georg Brauer, unter Mitarbeit von Marianne Baudler u. a. (Hrsg.): Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I. Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 203.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- A. G. Sharpe: Advances in Inorganic Chemistry. Academic Press, 1983, ISBN 0-08-057876-4, S. 163 (eingeschränkte Vorschau in der Google-Buchsuche).
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 719.