Niraparib
Niraparib (Handelsname Zejula; Hersteller Tesaro) ist ein Arzneistoff aus der Gruppe der PARP-Inhibitoren, der in der Behandlung von Ovarialkarzinom (Eierstockkrebs) eingesetzt wird.[3][4]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
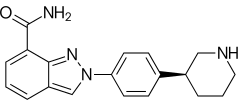 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Freiname | Niraparib | ||||||||||||||||||
| Andere Namen |
2-{4-[(3S)-3-Piperidyl]phenyl}indazol-7-carboxamid | ||||||||||||||||||
| Summenformel | C19H20N4O | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code | |||||||||||||||||||
| Wirkstoffklasse | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 320,39 g·mol−1 | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Die Europäische Kommission (EC) hat im November 2017 die Zulassung für Zejula (Niraparib) in der Europäischen Union (EU) erteilt. Zejula ist der erste in Europa zugelassene orale, einmal täglich einzunehmende Poly (ADP-Ribose)-Polymerase (PARP) 1/2-Inhibitor, für den keine Testung des BRCA-Mutationsstatus oder eine andere Biomarkertestung erforderlich ist.[5] Niraparib wurde im März 2017 von der US-amerikanischen Zulassungsbehörde (FDA) für die USA zugelassen.[6][7]
Ovarialkarzinom in Europa
Europa weist mit etwa 45.000 jährlich neudiagnostizierten Frauen eine der höchsten Inzidenzen von Ovarialkarzinomen in der Welt auf.[8][9] Das Ovarialkarzinom betrifft etwa 1,3 von 10.000 Frauen in der Europäischen Union, wo es die sechsthäufigste Krebsart bei Frauen und die fünfhäufigste krebsbedingte Todesursache bei Frauen ist.[9][10] Trotz der hohen initialen Ansprechraten auf platinbasierte Chemotherapien, tritt bei etwa 85 % der Patientinnen mit fortgeschrittenem Ovarialkarzinom ein Rezidiv nach der Erstlinienbehandlung auf. Die Wirksamkeit der Chemotherapien nimmt auch mit steigender Therapielinie ab.
Klinische Angaben
Anwendungsgebiete
Niraparib wird als Monotherapie zur Erhaltungstherapie bei erwachsenen Patientinnen mit Rezidiv eines Platin-sensitiven, gering differenzierten serösen Karzinoms der Ovarien (Eierstöcke), der Tuben (Eileiter) oder mit primärer Peritonealkarzinose, die sich nach einer Platin-basierten Chemotherapie in Remission (komplett oder partiell) befinden, angewendet.[5][11]
Art und Dauer der Anwendung
Die zugelassene Anfangsdosis von Zejula beträgt 300 Milligramm einmal täglich. Bei Patienten unter 58 Kilogramm kann eine Anfangsdosis von 200 Milligramm einmal pro Tag in Betracht gezogen werden.[5][11][12]
Unerwünschte Wirkungen
Die häufigsten unerwünschten Wirkungen sind Thrombozytopenie (34 %), Anämie (25 %), Neutropenie (20 %) und Hypertonie (8 %). Nach individueller Dosisanpassung war die Inzidenz von Grad 3/4 Thrombozytopenie gering und lag nach drei Monaten bei 2,4 %. Der Großteil der hämatologischen Nebenwirkungen ließ sich durch Dosismodifikationen gut handhaben. Die Rate an Therapieabbrüchen aufgrund von Thrombozytopenie, Neutropenie und Anämie lag bei 3 % bzw. 2 % und 1 %.[5]
Wirkungsmechanismus
PARP-Inhibitoren sind Hemmstoffe des Enzyms Poly-ADP-Ribose-Polymerase (PARP) und verhindern, dass Krebszellen einen durch Zytostatika induzierten DNA-Schaden reparieren. PARP-Inhibitoren kommen deshalb primär als Erhaltungstherapie nach einer Chemotherapie infrage.
Sonstige Informationen
Zulassungssituation / Orphan Drug Status
Die FDA hat Niraparib im März 2017 für die USA und die EC im November 2017 für die EU zugelassen.[6][5] Der Zulassung in den USA war eine FDA Fast Track Designation vorausgegangen, was den Zulassungsprozess wesentlich beschleunigte.[13] Im September 2017 hatte der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Arzneimittel-Agentur (EMA) eine positive Beurteilung für den Zulassungsantrag von ZEJULA® (Niraparib) gegeben.[14]
Im April 2010 resp. im August 2010 war Niraparib seitens der FDA resp. der EC der Orphan Drug Status für die Behandlung seltener Krankheiten gewährt worden.[15][16]
Leitlinien
Das National Comprehensive Cancer Network (NCCN) hat Niraparib in die Behandlungsleitlinien des Ovarialkarzinoms Version 1.2017 (April 2017) als Erhaltungstherapie für Patientinnen mit platinsensitiver Erkrankung, die ein partielles oder komplettes Ansprechen nach Beendigung von zwei oder mehr Linien platinbasierter Chemotherapie aufgenommen.[17]
Studien
Die EU-Zulassung von Niraparib basiert auf den Daten der klinischen Studie ENGOT-OV16/NOVA, einer doppelblinden, placebokontrollierten, internationalen Phase-3-Studie mit Niraparib, an der 553 Patientinnen mit rezidiviertem Ovarialkarzinom teilnahmen, die auf ihre letzte Platin-basierte Chemotherapie vollständig oder partiell angesprochen hatten. Primärer Studienendpunkt war das progressionsfreie Überleben (PFS). Etwa zwei Drittel der Patientinnen wiesen keine BRCA-Keimbahnmutation auf. Die Progression wurde in der NOVA-Studie durch einen unabhängigen zentralen Review der radiologischen oder klinischen Progression beurteilt.
Zejula verlängerte das PFS gegenüber dem Kontrollarm bei Frauen mit und ohne BRCA-Keimbahnmutation signifikant. Das Risiko für eine Krankheitsprogression oder Tod wurde durch Zejula bei Frauen mit BRCA-Keimbahnmutation um 73 % (HR 0,27) und bei Frauen ohne BRCA-Keimbahnmutation um 55 % verringert (HR 0,45). Nach zwei Jahren unter Niraparib waren noch 42 % der Frauen mit BRCA-Keimbahnmutation ohne Krankheitsprogression gegenüber 16 % der Frauen, die ein Placebo bekommen hatten. Patientinnen mit zu Studienbeginn partiellem oder vollständigem Ansprechen auf die Chemotherapie profitierten in gleichem Maße.
Die vollständigen Ergebnisse der ENGOT-OV16/NOVA-Studie wurden im Oktober 2016 auf dem Kongress der European Society for Medical Oncology (ESMO) in Kopenhagen vorgestellt.[18] Die Daten wurden zeitgleich im New England Journal of Medicine publiziert.[4][19]
Tesaro hat ein umfangreiches Niraparib-Studienprogramm aufgestellt, indem es die Aktivität von Niraparib über mehrere Krebsarten hinweg bewertet. Außerdem werden mehrere mögliche Kombinationen von Niraparib mit anderen Therapeutika evaluiert. Das laufende Entwicklungsprogramm für Niraparib umfasst eine Phase-3-Studie mit Patienten, die eine Erstlinientherapie zur Behandlung von Eierstockkrebs (PRIMA-Studie) erhalten haben, und eine Phase-2-Zulassungsstudie bei Patienten, die mehrere Behandlungslinien für Eierstockkrebs (QUADRA-Studie) erhielten. Mehrere Kombinationsstudien sind im Gange; darunter Studien mit Niraparib plus Pembrolizumab (TOPACIO-Studie) und Niraparib plus Bevacizumab (AVANOVA-Studie).[5][20]
Auslizenzierung
Janssen Biotech hat die Rechte zur Entwicklung und Vermarktung von Niraparib speziell für Patienten mit Prostatakrebs weltweit – außer in Japan – lizenziert.[5]
Literatur
- Lotte van Andel et al.: Human mass balance study and metabolite profiling of 14C-niraparib, a novel poly(ADP-Ribose) polymerase (PARP)-1 and PARP-2 inhibitor, in patients with advanced cancer, Investigational New Drugs, März 2017, doi:10.1007/s10637-017-0451-2
- Susanne Heinzl: European Society for Medical Onkology (ESMO) 2016 – Rezidiviertes Ovarialkarzinom: Niraparib verlängert progressionsfreies Überleben, Medscape – 10. Oktober 2016.
Weblinks
Einzelnachweise
- New ATC/DDD classification; Implementation in the ATC/DDD (index: 2018) WHO Collaborating Centre for Drug Statistics Methodology, abgerufen am 4. Dezember 2017.
- selleck.cn: MSDS, abgerufen am 27. Dezember 2019.
- European public assessment report (EPAR) for Zejula, WebSite EMA, abgerufen am 5. Dezember 2017.
- Mirza MR et al.: Niraparib Maintenance Therapy in Platinum-Sensitive, Recurrent Ovarian Cancer. In: New England Journal of Medicine. Nr. 375, 2016, S. 2154–2164. doi:10.1056/NEJMoa1611310.
- TESARO Announces European Commission Approval of ZEJULA® for Women With Recurrent Ovarian Cancer (Memento vom 1. Dezember 2017 im Internet Archive), PM TESARO vom 20. November 2017, abgerufen am 4. Dezember 2017.
- Niraparib (ZEJULA), PM FDA vom 27. März 2017, abgerufen am 4. Dezember 2017.
- TESARO Announces Availability of Zejula™ (Niraparib) for Patients With Recurrent Ovarian Cancer in the U.S., PM TESARO vom 19. April 2017, abgerufen am 4. Dezember 2017.
- World Cancer Research Fund International, abgerufen am 4. Dezember 2017.
- EUCAN (EU, EEA and Switzerland) (Memento vom 5. Dezember 2017 im Internet Archive) Estimated incidence, mortality & prevalence, 2012, abgerufen am 4. Dezember 2017.
- CDC Ovarian Cancer Statistics, abgerufen am 4. Dezember 2017.
- Zejula 100mg Hartkapseln, Fachinformation auf www.fachinfo.de (zugangsgeschützt, nur für Fachkreise), abgerufen am 12. Dezember 2017.
- Jones P et al.: Niraparib: A Poly(ADP-ribose) Polymerase (PARP) Inhibitor for the Treatment of Tumors with Defective Homologous Recombination. In: Journal of Medicinal Chemistry. Nr. 58, 2015, S. 3302–3314. doi:10.1021/jm5018237.
- Niraparib Receives FDA Fast Track Designation for the Treatment of Recurrent Platinum-Sensitive Ovarian, Fallopian Tube, or Primary Peritoneal Cancer, PM ESMO vom 15. September 2016, abgerufen am 4. Dezember 2017.
- Zejula – Opinion, Europäische Arzneimittel-Agentur, abgerufen am 4. Dezember 2017.
- Search Orphan Drug Designations and Approvals, Accessdata FDA, abgerufen am 3. Dezember 2017.
- orphan designation, Europäische Arzneimittel-Agentur, abgerufen am 4. Dezember 2017.
- NCCN Guidelines for Patients | Ovarian Cancer, abgerufen am 4. Dezember 2017.
- Wang J et al. The Exposure-Response Relationship of Niraparib in Patients with gBRCAmut and Non-gBRCAmut: Results from the ENGOT-OV16/NOVA Trial. ESMO; 2017 Sep 8–12; Madrid, Spain.
- A Maintenance Study With Niraparib Versus Placebo in Patients With Platinum Sensitive Ovarian Cancer, clinicaltrials.gov, abgerufen am 4. Dezember 2017.
- RESEARCH CENTER, TESARO Website, abgerufen am 4. Dezember 2017.