Niob(III)-fluorid
Niob(III)-fluorid ist eine chemische Verbindung des Niobs aus der Gruppe der Fluoride.
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
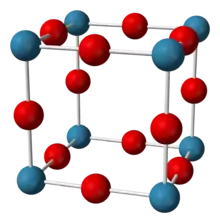 | ||||||||||
| _ Nb3+ _ F− | ||||||||||
| Allgemeines | ||||||||||
| Name | Niob(III)-fluorid | |||||||||
| Andere Namen |
Niobtrifluorid | |||||||||
| Verhältnisformel | NbF3 | |||||||||
| Kurzbeschreibung | ||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 149,9 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte |
4,02 g·cm−3[1] | |||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit |
löslich in Flusssäure[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Gewinnung und Darstellung
Niob(III)-fluorid kann durch Reaktion von Niob mit Fluorwasserstoff bei 225 °C gewonnen werden.[4] Die Verbindung kann auch durch Reduktion von Niob(V)-fluorid mit Niob bei 750 °C und hohem Druck oder durch Reaktion von Niobhydrid mit einem Fluorwasserstoff-Wasserstoff-Gemisch gewonnen werden.[5][6]
Eigenschaften
Niob(III)-fluorid ist ein blauer bis schwarzer Feststoff. Die Verbindung ist ein Halbleiter und besitzt eine kubische Kristallstruktur vom Rheniumtrioxidtyp[7] mit der Raumgruppe Pm3m (Raumgruppen-Nr. 221).[1][2]
Einzelnachweise
- R. Blachnik: Taschenbuch für Chemiker und Physiker Band 3: Elemente, anorganische Verbindungen und Materialien, Minerale. Springer-Verlag, 2013, ISBN 978-3-642-58842-6, S. 632 (eingeschränkte Vorschau in der Google-Buchsuche).
- William M. Haynes: CRC Handbook of Chemistry and Physics, 97th Edition. CRC Press, 2016, ISBN 978-1-4987-5429-3, S. 106 (eingeschränkte Vorschau in der Google-Buchsuche).
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- A. P. Hagen: Inorganic Reactions and Methods, The Formation of Bonds to Halogens. John Wiley & Sons, 2009, ISBN 0-470-14539-0, S. 178 (eingeschränkte Vorschau in der Google-Buchsuche).
- Jane E. Macintyre: Dictionary of Inorganic Compounds. CRC Press, 1992, ISBN 978-0-412-30120-9, S. 3168 (eingeschränkte Vorschau in der Google-Buchsuche).
- J.H. Simons: Fluorine Chemistry. Elsevier, 2012, ISBN 0-323-14724-0, S. 48 (eingeschränkte Vorschau in der Google-Buchsuche).
- Nebengruppenelemente, Lanthanoide, Actinoide, Transactinoide Band 2: Nebengruppenelemente, Lanthanoide, Actinoide, Transactinoide, Anhänge. Walter de Gruyter GmbH & Co KG, 2016, ISBN 978-3-11-049339-9 (eingeschränkte Vorschau in der Google-Buchsuche).
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. The authors of the article are listed here. Additional terms may apply for the media files, click on images to show image meta data.