N-Alkyl-β-aminopropionsäuren
N-Alkyl-β-aminopropionsäuren sind Derivate der nichtproteinogenen Aminosäure β-Alanin, in denen das Stickstoffatom in der Regel eine längere (≥ C8) unverzweigte oder verzweigte Alkylgruppe CnH2n+1 trägt. Bei der technischen Synthese entstehen N-Alkyl-β-aminopropionsäuren stets zusammen mit N-Alkyliminodipropionsäuren. N-Alkyl-β-alanine sind wegen der Aminogruppe und der Carboxygruppe im Molekül Zwitterionen und aufgrund der langen Alkylkette amphotere Tenside mit vielfältigen kosmetischen und technischen Anwendungen. Weitere Amphotenside mit zwitterionischen Eigenschaften sind Betaine, Sulfobetaine, Aminoxide, Amphoacetate und Amphodiacetate, wie z. B. das Dinatriumcocoamphodiacetat.[1]
Herstellung
Bei der von Walter Reppe bei den I.G. Farben AG erstmals im Jahr 1938 beschriebenen Synthese „neuer Aminocarbonsäuren“[2] handelt es sich um eine Michael-Addition von Acrylsäure an ein längerkettiges Amin, z. B. Dodecylamin. Das Reppe-Patent beschreibt bei der Addition von wässriger Acrylsäure an überschüssiges Dodecylamin die Bildung von N-Dodecyl-β-aminopropionsäure, bei überschüssiger Acrylsäure die Entstehung von N-Dodecyliminodipropionsäure bzw. deren Natriumsalze nach Neutralisierung mit Natriumcarbonat. Analytische Daten zu den Endprodukten fehlen jedoch.
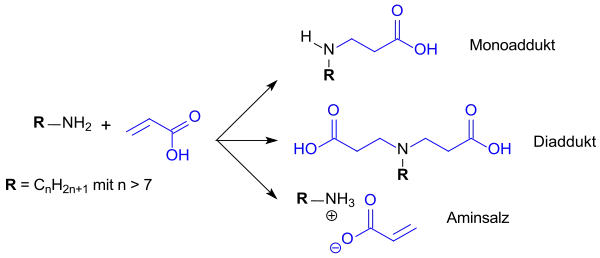
Abhängig von den Einsatzfaktoren der Ausgangsstoffe und den Prozessbedingungen erhält man bei der industriellen Synthese stets ein Gemisch von Aminopropionsäure (Monoadditionsprodukt), Iminodipropionsäure (Diadditionsprodukt) und dem Aminsalz mit Acrylsäure (Ausgangsstoffe). Längerkettige Amine (> C14), höhere Temperaturen (> 150 °C) und längere Reaktionszeiten (> 10 h) verschieben bei annähernd äquimolaren Einsatzmengen die Ausbeuten hin zu mehr Monoprodukt. Diese Bedingungen sind jedoch unökonomisch und führen zu unerwünschter Gelbfärbung des Ansatzes, sowie zur thermisch induzierten Polymerisation der Acrylsäure. Nachteilig ist neben der relativ undefinierten Produktzusammensetzung der Gehalt an nicht umgesetztem Amin und Acrylsäure, der zu Geruchsbelästigungen und Hautirritationen führt und besonders in kosmetischen Anwendungen, z. B. in Shampoos, nicht toleriert werden kann.
Die Uneinheitlichkeit der bei der industriellen Synthese von N-Alkyl-β-alaninen erhaltenen Produktgemische hat Bemühungen in Gang gesetzt, durch Änderung der Reaktanden und der Prozessbedingungen zu besser definierten Produkten zu kommen. So wurden statt Acrylsäure kurzkettige Acrylsäureester, meist das stechend riechende Methylacrylat, oder Katalysatoren[3] für die Michael-Addition eingesetzt, die zwar niedrigere Reaktionstemperaturen, z. B. 30 °C[4] und kürzere Reaktionszeiten erlauben, aber einen bzw. zwei zusätzliche Prozessschritte – Hydrolyse des N-Alkyl-β-alaninesters mit Alkalihydroxiden und anschließendes Ansäuern – zur Darstellung der Säure, beinhalten.
Systematische Untersuchungen mit den Reaktanden Laurylamin bzw. Cocoalkylamin und Acrylsäure[5] zeigen, dass durch Variation des pH-Werts bei der Reaktion nur leicht unterschiedliche Produktzusammensetzungen erhalten werden. Typischerweise werden mit Cocoalkylamin bei pH ≈ 6 überwiegend das Monoaddukt N-Cocoalkylaminopropionsäure (45 % Monoaddukt, 28 % Diaddukt, 27 % Aminsalz), bei pH ≈ 4,5 überwiegend das Diaddukt (38 % Mono-, 41 % Diaddukt, 21 % Aminsalz) gebildet.
Für technische Anwendungen lohnt die nachträgliche Auftrennung des Stoffgemisches Aminopropionsäure/Iminodipropionsäure, z. B. durch Flash-Chromatographie, nicht.[6] Die Aminsalze können dagegen einfach auskristallisiert werden, so dass salzfreie Lösungen erhalten werden.
Eigenschaften
Das bei der industriellen Synthese von N-Alkyl-β-aminopropionsäuren anfallende Stoffgemisch wird mit Wasser auf ca. 30 bis 50 % Feststoffanteil verdünnt und ergibt meist klare, gelbe Lösungen, deren pH-Wert auf 8 bis 10 eingestellt wird.[7]
N-Alkyl-β-alanine sind wenig bis nicht-schäumende Tenside, die in sauren und alkalischen Medien ebenso stabil sind wie in hartem Wasser oder gegenüber hohen Elektrolytkonzentrationen, wie z. B. in Meerwasser. Im Gegensatz zu den meisten Tensiden sind die in einem weiten pH-Bereich gut wasserlöslichen N-Alkyl-β-aminopropionsäuren-Gemische mit kationischen, anionischen und nichtionischen Tensiden kompatibel.
Bemerkenswert ist die hohe Hydrotropie dieser Gemische, die die Viskosität wässriger Systeme reduziert und über ihre lösungsvermittelnde Wirkung die Phasentrennung ansonsten unverträglicher Komponenten unterdrückt. Dabei sind Iminodipropionate mit zwei Carboxygruppen hydrophiler als Aminopropionsäuren, in denen bei der Michael-Reaktion nur ein Acrylsäurerest an das Amin addiert wird.
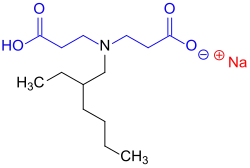
Diese Tenside, insbesondere das Diadditionsprodukt Octyliminodipropionat (CAS-Nr. 94441-92-6, EC-Nr. 305-318-6), zeichnen sich auch durch eine ausgeprägte und anhaltende Wirksamkeit als Korrosionsschutzmittel aus.
Bei basischem pH-Wert sind die Lösungen haut- und augenreizend, aber unter Normalbedingungen gut bioabbaubar[8] und ungiftig.[9]
Verwendung
N-Alkyl-β-aminopropionsäuren finden vielfältige Anwendungen, z. B.:
- als Hydrotrop zur Erhöhung der Löslichkeit insbesondere von nichtionischen Tensiden und der Stabilität der erhaltenen Zubereitungen, auch bei hohen Elektrolytkonzentrationen
- als Lösungsvermittler für kationische Tenside in Reinigern mit antibakterieller Wirkung
- als Co-Tensid in Oberflächenreinigern (engl. hard surface cleaners) für industrielle und gewerbliche Zwecke (engl. industrial and institutional cleaning, I&I), z. B. auch Cleaning in Place CIP in der Lebensmittelindustrie[10]
- als Schaumstabilisator in konzentrierten Salzlösungen, wie z. B. in Bohrspülungen bei der Ölexploration und -förderung[11]
- als Entfettungsmittel in hochalkalischen Reinigern, in denen die meisten ionischen und nichtionischen Emulgatoren unwirksam sind
- als Korrosionsinhibitor in Kühlschmiermitteln zur Metallbearbeitung
Einzelnachweise
- Eric G. Lomax: Amphoteric Surfactants, 2nd Edition. Marcel Dekker, Inc., Nw York, NY, U.S.A. 1996, ISBN 0-8247-9392-7.
- Patent US2195974: Process of producing new aminocarboxylic acids. Angemeldet am 10. Juli 1937, veröffentlicht am 2. April 1940, Anmelder: I.G. Farbenindustrie AG, Erfinder: W. Reppe, H. Ufer.
- J. Comelles, M. Moreno-Mañas, A. Vallribera: Michael additions catalyzed by transition metals and lanthanide species. A Review. In: ARKIVOC. ix, 2005, S. 207–239 (arkat-usa.org).
- Patent US2468012: Beta amino propionates. Angemeldet am 6. August 1945, veröffentlicht am 19. April 1949, Anmelder: General Mills, Inc., Erfinder: A.F. Isbell.
- Patent WO9950227: Process for the selective control of zwitterionic amphoteric surfactant compositions. Angemeldet am 24. März 1999, veröffentlicht am 7. Oktober 1999, Anmelder: Akzo Nobel N.V., Erfinder: L.J. Joffre.
- J. Escalante, M. Carrillo-Morales, I. Lanzaga: Michael additions of amines to methyl acrylates promoted by microwave irridiation. In: Molecules. Band 13, Nr. 2, 2008, S. 340–347, doi:10.3390/molecules13020340.
- Ampholak YJH-40, Octyliminodipropionate. (PDF; 46 kB) In: surfacechemistry.nouryon.com. Nouryon, abgerufen am 12. Oktober 2019 (englisch).
- ColaRTeric ZF-50. (PDF; 189 kB) In: colonialchemical.com. Colonial Chemical, Inc., abgerufen am 12. Oktober 2019 (englisch).
- C.L. Burnett et al.: Safety Assessment of Lauriminodipropionic Acid, Sodium Lauriminodipropionate, and Disodium Lauriminodipropionate as Used in Cosmetics. In: Int. J. Toxicol. Band 32, Nr. 3, 2013, S. 49S–55S, doi:10.1177/1091581813497765.
- DeriphatR 160 C, Technical Bulletin. (PDF; 31 kB) BASF Corp., abgerufen am 12. Oktober 2019 (englisch).
- FlexisurfTM EHDP, Technical Data Sheet. (PDF; 349 kB) Innovative Chemical Technologies, Inc., abgerufen am 12. Oktober 2019 (englisch).