Amphoacetate
Amphoacetate sind eine Klasse amphoterer Tenside, die abhängig vom pH-Wert als anionische, kationische oder nichtionische oberflächenaktive Verbindungen (Detergentien) vorliegen können.
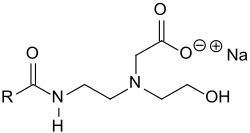
Am häufigsten werden diese Verbindungen in Form ihrer Natriumsalze verwendet, die ein hohes Schaumvermögen besitzen und nur geringe Haut- und Augenreizungen verursachen.
Herstellung
Die Synthese von Amphoacetaten verläuft in zwei Reaktionsstufen. In der ersten Stufe reagiert eine langkettige Fettsäure (> C8-Kettenlänge) oder ein Fettsäuregemisch (z. B. durch Hydrolyse von Kokosöl, Palmöl oder Sojaöl) beim Erhitzen mit 2-(2-Aminoethylamino)ethanol unter vermindertem Druck auf Temperaturen bis über 200 °C[1]. Dabei wird unter Wasserabspaltung das entsprechende 2-Alkyl-1-hydroxyethylimidazolin gebildet, das meist als niedrigschmelzendes weißes Wachs in Ausbeuten von > 95 % anfällt.[2]
In der zweiten Stufe wird das Imidazolin mit Natronlauge zum linearen Amidoamin hydrolysiert und mit einem geringen molaren Überschuss des Natriumsalzes der Monochloressigsäure in einem optimalen pH-Bereich von 8,5 bis 9,5 bei 75 °C carboxymethyliert.[3] Frühere Vermutungen, dass die Carboxymethylierung am Imidazolin-Ring erfolgt,[1][2] sind inzwischen widerlegt.[3] Die Reaktionsausbeute ist praktisch quantitativ. Zum Abschluss der Reaktion wird das Produkt mit Wasser auf einen Feststoffgehalt von ca. 45 % eingestellt.
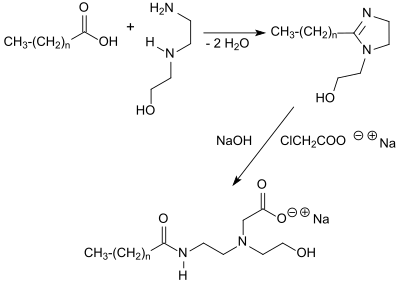
Die Reaktionsführung zielt darauf ab, bei möglichst vollständigem Umsatz des Amidoamins möglichst geringe Gesamtmengen des Nebenprodukts Natriumchlorid und des toxischen Reaktanden Natriummonochloracetat (< 115 ppm) zu erzeugen, sowie die Entstehung des Natriumsalzes der Glycolsäure – durch alkalische Hydrolyse aus Monochloressigsäure – auf möglichst geringe Werte (< 2,5 %) zu begrenzen. Verunreinigungen durch Glycolsäure sind wegen der hautreizenden und fehlenden grenzflächenaktiven Eigenschaften nachteilig.
Bei der Umsetzung des substituierten Hydroxyethylimidazolins mit höheren molaren Mengen an Monochloressigsäuresalz werden die so genannten Amphodiacetate gebildet. Bis zu vier verschiedene Strukturen für Amphodiacetate werden diskutiert,[3] von denen das O-carboxymethylierte Derivat C am häufigsten als Zielprodukt angegeben wird.[4][5][6][7]
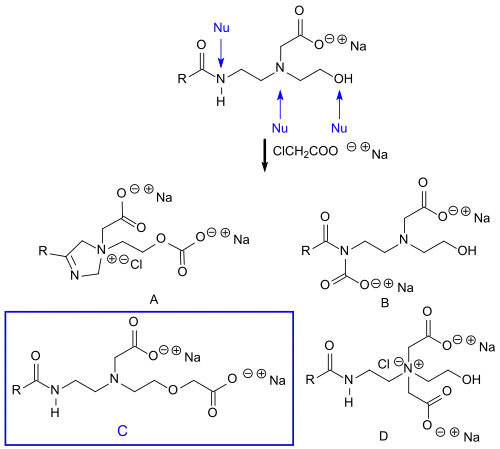
Größere Anteile an Amphodiacetaten im Gemisch mit Amphoacetaten sind unerwünscht, da sie insbesondere in hartem Wasser die Schaumhöhe von Amphoacetaten reduzieren.
Verwendung
Amphoacetate sind besonders milde Tenside mit geringer Reizwirkung auf Haut, Schleimhaut und Augen und werden daher häufig in Shampoos, Flüssigseifen und Duschgelen eingesetzt. Sie sorgen für eine schnelle Oberflächenbenetzung und Verringerung der Oberflächenspannung und sind gute Schaumbildner. Die in Körperpflegeprodukten unerwünschte aggressive Fettlösung anionischer Fettalkoholsulfate oder Alkylethersulfate, wie z. B. SLES wird durch Zugabe von Amphoacetaten abgemildert. Als Cotensid wirken sie als Löslichkeitsvermittler für hydrophobere Tenside und hydrotrop auf schwerlösliche Zusätze in Emulsionen. Amphoacetate sind mit anionischen, kationischen und nicht-ionischen Tensiden sowie mit Elektrolyten verträglich. Sie sind bioabbaubar und über einen breiten pH-Bereich hydrolytisch stabil.
Typische Zusammensetzungen kommerzieller Cocoamphoacetate und Cocoamphodiacetate sind in der folgenden Tabelle[8] wiedergegeben:
| Komponenten | Cocoamphoacetat | Cocoamphodiacetat |
|---|---|---|
| Wirksubstanz [%] | 45 | 50 |
| Natriumchlorid [%] | 7,5 | 13 |
| Cocosfettsäuren [%] | < 0,7 | < 0,7 |
| Glycolat [%] | < 4 | < 8 |
| Na-chloracetat [ppm] | variabel | 100 – 2000 |
Amphodiacetate sind selbst gute Schaumbildner und verbessern die Hautverträglichkeit von Tensidmischungen, spielen jedoch wegen ihrer meist deutlich höheren Glycolat- und Monochloressigsäuregehalte nur eine marginale Rolle.
Wegen ihrer ausgeprägten Hautfreundlichkeit und Schaumbildungsneigung finden sich Amphoacetate vorwiegend in Babyshampoos und -seifen, sowie in flüssigen Geschirrspülmitteln. In vielen technischen Anwendungen hingegen ist die Schaumbildung der Amphoacetate unerwünscht und der vergleichsweise hohe Preis ungünstig.
Die größte Verbreitung im Markt haben Amphoacetate aus Kokosfettsäuren (INCI Name: Sodium Cocoamphoacetate) und Amphodiacetate (INCI Name: Disodium Amphodiacetate) gefunden, die von einer Vielzahl von Spezialchemieunternehmen unter den jeweiligen Markennamen vertrieben werden, u. a. BASF als DehytonR, Colonial Chemical als ColaRTeric, Croda International als CrodatericTM CY, Evonik Industries als Rewoteric AM C, Kaō als BetadetR THC, Rhodia als MiranolR Ultra C32 oder MackamR 1C bzw. 2C und Stepan Company als AmphosolR 1C bzw. 2C.
Literatur
- Drew Myers: Surfactants Science and Technology, 3rd Edition. John Wiley & Sons, Hoboken, NJ, USA 2005, ISBN 978-0-471-68024-6, doi:10.1002/047174607X.
- Amphoteric Surfactants, 2nd Edition. In: Eric G. Lomax (Hrsg.): Surfactant Science Series, Volume 59. Marcel Dekker, Inc., New York, NY, USA 1996, ISBN 0-8247-9392-7.
Einzelnachweise
- Patent US2528378: Metal salts of substituted quaternary hydroxy cycloimidinic acid metal alcoholates and process for preparation of same. Angemeldet am 20. September 1947, veröffentlicht am 31. Oktober 1950, Anmelder: J.J. McCabe, H.S. Mannheimer, Erfinder: H.S. Mannheimer.
- Patent US4269730B: Substituted imidazoline reactions with chloroacetate salts. Angemeldet am 28. August 1979, veröffentlicht am 26. Mai 1981, Anmelder: Stepan Chemical Co., Erfinder: J.R. Wechsler, T.G. Baker, G.T. Battaglini, F.L. Skradski.
- Patent US6057282: High purity imidazoline-based amphoacetate surfactants. Angemeldet am 23. August 1999, veröffentlicht am 2. Mai 2000, Anmelder: Rhodia Inc., Erfinder: B. Desai, P. Lees, J.-M. Ricca, D.J. Tracy.
- Externe Identifikatoren von bzw. Datenbank-Links zu Dinatriumlauroamphodiacetat: CAS-Nummer: 68298-20-4, EG-Nummer: 269-546-7, ECHA-InfoCard: 100.063.205, PubChem: 109973, ChemSpider: 98782, Wikidata: Q27287787.
- AmphosolR 2C. (PDF; 48 kB) Product Bulletin. Stepan, 2012, abgerufen am 22. Juni 2018 (englisch).
- Mackam 2C. (PDF; 31 kB) Technical Data Sheet. Rhodia, März 2012, abgerufen am 22. Juni 2018 (englisch).
- ColaRTeric 2C. (PDF; 99 kB) Technical Data Sheet. Colonial Chemical, 2015, abgerufen am 22. Juni 2018 (englisch).
- U. Zoller, P. Sosis (Hrsg.): Handbook of Detergents, Part F: Production. CRC Press, Boca Raton, FL, USA 2009, ISBN 978-0-8247-0349-3, S. 223–227.