Merkelzell-Polyomavirus
Das Merkelzell-Polyomavirus (MCPyV oder MCV) wurde im Januar 2008 entdeckt.[2] MCPyV ist eines von sieben beim Menschen bekannten Onkoviren. Es soll die Mehrzahl aller Fälle von Merkelzellkarzinomen verursachen, einer seltenen, aber aggressiven Hautkrebsform. Bei ca. 80 % der Merkelzellkarzinome (MCC) wurden Infektionen mit MCPyV gefunden. Antikörper gegen das MCPyV (die einen Kontakt mit dem Virus anzeigen) können bei gesunden Personen je nach Altersgruppe bei bis zu 80 % der Probanden nachgewiesen werden, wobei diese Seroprävalenz bei Kindern unter 15 Jahren bereits 50 % beträgt.[3][4] Da es auch in Bronchialsekreten gefunden wurde, ist eine Übertragung über die Atemwege anzunehmen.[5][6] Diese Isolate bei gesunden Virusträgern entsprechen dem nichtmutierten Wildtyp. Die meisten aus MCC-Tumoren isolierten Virusgenome unterliegen allerdings mindestens zwei Mutationen, die sie nichtübertragbar machen: Erstens ist das Virus klonal in das Wirtsgenom integriert, und zweitens ist das virale T-Antigen durch eine Mutation verkürzt, sodass es die zur Vermehrung des viralen Genoms notwendige zelluläre DNA-Replikation nicht mehr anstoßen kann.[7]
| Merkelzell-Polyomavirus | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Systematik | ||||||||||||||||||||
| ||||||||||||||||||||
| Taxonomische Merkmale | ||||||||||||||||||||
| ||||||||||||||||||||
| Wissenschaftlicher Name | ||||||||||||||||||||
| Merkel cell polyomavirus | ||||||||||||||||||||
| Kurzbezeichnung | ||||||||||||||||||||
| MCPyV | ||||||||||||||||||||
| Links | ||||||||||||||||||||
|
Dass MCPyV die Ursache der damit infizierten MCC-Tumoren ist, wurde in Studien durch Hemmung der Virus-Onkoproteine belegt. Wenn man diese Virusproteine unterdrückt, sterben die Zellen von MCPyV-positiven Merkelzellkarzinomen ab, im Gegensatz zu den Zellen aus Tumoren, die das Virus nicht tragen.[8] Die viruspositiven Tumorzellen sind also auf MCPyV angewiesen.
MCPyV wird vom International Committee on Taxonomy of Viruses (ICTV) der Spezies Human polyomavirus 5 untergeordnet.[9]
Klassifikation
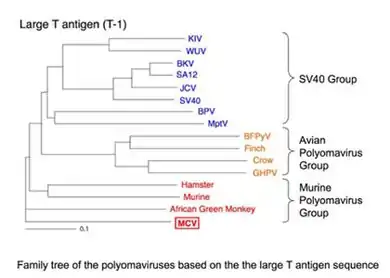
MCPyV ist das fünfte Polyomavirus, das beim Menschen entdeckt wurde. Das MCPyV wurde vorläufig als nicht-klassifizierte Spezies der Gattung Polyomavirus zugeordnet. Unter den drei Genogruppen dieser Gattung gehört es zur Gruppe des Murinen Polyomavirus.[2] Diese Gruppe ist nach dem zuerst entdeckten Murinen Polyomavirus benannt und impliziert nicht, dass MCPyV von Nagetieren auf den Menschen übertragen wird. MCPyV ist bis jetzt das einzige humane Polyomavirus, das nicht in die Gruppe der SV40-artigen fällt.[2]
MCPyV ist dem B-lymphotropen Polyomavirus genetisch sehr ähnlich[2] (früher African green monkey lymphotropic papovavirus genannt),[10] es könnte also eine Koevolution mit den Menschenaffen durchlaufen haben.
Virusgenom
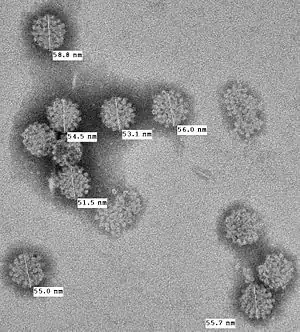
Polyomaviren sind etwa 50 nm kleine, hüllenlose Viren mit einer ringförmig geschlossenen Doppelstrang-DNA als Genom. Das Genom des MCPyV-Prototyps besteht aus 5387 Basenpaaren und kodiert charakteristische Proteine der Polyomaviren einschließlich eines großen T-Antigens und eines kleinen t-Antigens als Nicht-Strukturproteine sowie der Strukturproteine VP1 und VP2/3 zum Aufbau des Kapsids.[11] Das große MCPyV-T-Antigen gleicht den T-Antigenen anderer Polyomaviren, sogenannten Onkogenen, und wird wie in menschlichen Tumoren exprimiert.[2][7] Das T-Antigen ist ein gespleißtes Gen und erzeugt verschiedene Proteine je nach dem Spleißmuster. Große und kleine T-Antigen-Proteine können gesunde Zellen zu Tumorzellen transformieren, indem sie Tumorsuppressoren wie das Retinoblastom-Protein hemmen. Das große T-Antigen besitzt auch eine DNA-Helikase und eine Bindungsstelle für den Replikationsursprung der Virus-DNA, die die zelluläre DNA-Polymerase benötigt, um das virale Genom zu replizieren. Das Virus selbst kodiert für keine eigene virale DNA-Polymerase, weshalb es wie bei allen Polyoma- und Papillomviren auf die nur während der Zellteilung (S-Phase) aktive zelluläre DNA-Polymerase angewiesen ist. Die Replikation des Virusgenoms geschieht daher wie bei allen DNA-Viren im Zellkern der Wirtszelle.
Virale Ätiologie des Merkelzellkarzinoms
Das Merkelzellkarzinom ist ein hochaggressiver Hautkrebs, der zuerst 1972 von Cyril Toker als "trabekulärer Hauttumor" beschrieben wurde.[12] Der Krebs scheint von den mikroskopisch kleinen Merkel-Körperchen in der Haut und den Eingeweiden abzustammen, die für Berührungs- und Druckempfindungen verantwortlich sind.[13] Dementsprechend zählt man ihn zu den neuroektodermalen Tumoren. MCC sind im Vergleich zu anderen Hautkrebsarten selten, doch hat sich ihre Inzidenz in den USA zwischen 1986 und 2001 verdreifacht auf ca. 1400 Fälle pro Jahr.[14]
Merkelzellkarzinome werden überwiegend bei älteren Menschen gefunden.[14] Man weiß auch, dass Patienten mit Immundefekten öfter erkranken, z. B. nach Organtransplantationen oder mit einer AIDS-Infektion,[15][16] und diese Tatsache stützt die Vermutung, dass ein Virus oder anderes infektiöses Agens an der Krebsentstehung beteiligt ist. Kaposi-Sarkome und Burkitt-Lymphome sind Beispiele für Tumoren mit bekannter viraler Ätiologie, die bei immunsupprimierten Personen häufiger auftreten. Ein weiterer Risikofaktor für die Entstehung von MCC ist ultraviolettes Licht.[14]
In einer ersten Studie waren acht von zehn Merkelzellkarzinomen mit MCPyV infiziert.[2] Das Virus ist in diesen Tumoren im Krebszellgenom integriert und kann sich nicht mehr frei vermehren. Aktuelle Studien aus anderen Laboratorien haben das bestätigt: In einer Studie waren 30 von 39 (77 %) der Merkelzelltumoren MCPyV-positiv;[17] in einer anderen Studie 45 von 53 (85 %).
Die Viren aus Merkelzelltumoren wurden sequenziert; sie wiesen regelmäßig tumorspezifische Mutationen auf, die das MCPyV-T-Antigen verkürzen. Diese Mutationen (die im aus nichttumorösem Gewebe isolierten, nativen Virus nicht vorkommen) eliminieren die T-Antigen-Helikase und hindern damit das integrierte Virus daran, sich unabhängig von der Wirtskrebszelle zu vermehren.[7] Der Tumor ist für das Virus eine "Sackgasse".[18] Normalerweise existiert das Virus als kreisförmiges Episom (oder Plasmid) innerhalb der Zelle, und seine DNA wird in virale Kapside verpackt und auf andere Zellen übertragen. In Tumorzellen ist die Virus-DNA aufgebrochen und in die menschliche DNA integriert, sodass das Virus nicht mehr übertragbar ist. Es kann die Wirtszelle nicht verlassen und sich nur gemeinsam mit der Wirtszelle vermehren. Untersuchungen von infizierten Tumoren haben gezeigt, dass sie mehrheitlich ein klar monoklonales Muster besitzen, was darauf hinweist, dass das Virus ursprünglich in eine einzelne Zelle eindrang, bevor sie ihre krebsartige Vermehrung begann.[2] Dies sind sehr starke Belege dafür, dass MCPyV einige – aber nicht alle – Merkelzellkarzinome verursacht. MCPyV kann auch in Normalgewebe von Personen ohne Merkelzellkarzinom gefunden werden. Ein vollständiges MCPyV-Genom (MCV-HF) wurde aus mehreren MCPyV-Genomen des Tumortyps zusammengesetzt und hatte in vitro die Fähigkeit zu erfolgreicher Replikation.[19] Identische Sequenzen wurden in normaler menschlicher Haut gefunden.[20] Die genaue Prävalenz der Infektion beim Menschen ist unbekannt, aber es ist wahrscheinlich, dass die meisten Infektionen keinen Krebs verursachen.[21]
Vorbeugung, Diagnose, Behandlung

Patienten mit viruspositivem Merkelzellkarzinom sind für andere nicht infektiös, Schutzmaßnahmen sind nicht erforderlich. Das liegt daran, dass einerseits das Tumorvirus bereits mutiert und nicht mehr übertragbar ist, und andererseits die meisten Personen dem Virus durch asymptomatische Überträger schon in ihrer Kindheit oder als junge Erwachsene ausgesetzt waren.
Nach der gegenwärtigen Datenlage kann man MCC ebenso wie anderen Hautkrebsarten vorbeugen, indem man Sonnenbrand und unnötige Sonnenbestrahlung verhindert und Sonnenschutzmittel verwendet. So können risiko-erhöhende Virusmutationen bei den bereits mit MCPyV infizierten Personen verhindert werden. Menschen mit Immunsuppression (z. B. AIDS-Patienten oder Organempfänger) tragen ein höheres Erkrankungsrisiko für diese Krebsart und könnten von regelmäßigen Hautuntersuchungen profitieren. Jede schmerzlose, schnell wachsende Geschwulst, insbesondere bei über 50-Jährigen oder Immunsupprimierten, muss einem Arzt gezeigt werden. Die Diagnose des Merkelzelltumors kann durch eine Biopsie schnell erbracht werden, und im frühen Stadium ist die Prognose nach der Standardtherapie gut. Es gibt bis jetzt keine vorbeugenden Impfungen oder Medikamente, die die Infektion oder die Karzinomentstehung verhindern könnten.
Der Nachweis des Virus ist Gegenstand von Forschungen und als klinischer Test in der Regel nicht verfügbar. Die virale DNA wird mittels PCR oder Southern Blot nachgewiesen. Beim Interpretieren der PCR-Ergebnisse ist Vorsicht geboten, denn es gibt falsch-positive Kontaminationen, und ein beträchtlicher Anteil der Proben aus gesunder Haut kann schwach infiziert sein. Die An- oder Abwesenheit von tumorspezifischen Mutationen kann durch Sequenzierung des Virusgenoms bestimmt werden.
Man hat Antikörper entwickelt, die das T-Antigen im Tumorgewebe anfärben[22] und offenbar spezifisch für MCPyV-infizierte Krebszellen sind.[23][24] Auch Bluttests wurden entwickelt,[3][4] die zeigen, dass die Mehrzahl der Erwachsenen MCPyV schon ausgesetzt war und es vielleicht als asymptomatische Infektion tragen.
Die Behandlungsleitlinien unterscheiden nicht zwischen Merkelzellkarzinomen mit und ohne MCPyV-Infektion. Eine kürzlich in Finnland erstellte, landesweite Studie legt nahe, dass MCPyV-positive Tumoren eine bessere Prognose als nichtinfizierte Tumoren haben[25] (allerdings ergaben andere Studien das nicht[18]). Sollte sich das bestätigen, dann könnte ein routinemäßiger Virusnachweis in der Krankenbehandlung künftig nützlich sein. Das Virus selbst ist nach bisherigem Kenntnisstand unempfindlich gegen gängige antivirale Medikamente.
Entdeckung und Beschreibung des MCPyV
Yuan Chang und Patrick S. Moore, die 1994 das Kaposi-Sarkom-Herpesvirus entdeckt hatten,[26] verwendeten gemeinsam mit ihren Kollegen Huichen Feng und Masa Shuda in der Universität von Pittsburgh (USA) die neue Hochgeschwindigkeits-Sequenzierungstechnik der digitalen Transkriptom-Subtraktion (DTS),[27] um in Merkelzelltumoren nach einem Virus zu suchen.[2] Bei dieser Methode konvertiert man die ganze mRNA aus dem Tumor in cDNA und sequenziert tief genug, um eine virale cDNA aufzufinden, falls eine solche vorhanden ist. Die Sequenzen werden dann mit dem menschlichen Genom verglichen, und alle menschlichen Sequenzen werden "subtrahiert", sodass eine Anzahl von höchstwahrscheinlich nichthumanen Sequenzen übrigbleibt. Als man dies mit vier Fällen von Merkelzellkarzinomen durchführte, fand man eine cDNA, die den Sequenzen bekannter Polyomaviren glich, aber doch mit genug Unterschieden, um sie als ein neues Virus zu identifizieren.[2] Für die Studie wurden genetische Sequenzen aus fast 400.000 mRNA-Strängen analysiert. Nachdem das Virus einmal gefunden war, stellten Feng und Mitarbeiter schnell fest, dass die infizierten Merkelzellkarzinome es in einem integrierten monoklonalen Muster trugen und dass nur 8–16 % der Gewebeproben von Patienten ohne MCC für das Virus positiv waren. Das wurde schnell durch Studien an MCC-Patienten in der ganzen Welt bestätigt; einschließlich Beweisen für die monoklonale Integration des Virus in diesen Tumoren.[17][18][28][29]
MCPyV als eine Ursache für Merkelzellkarzinome
Während die Originalautoren zurückhaltend anmerkten, dass es „zu früh“ sei, um festzustellen, ob MCPyV eine Ursache für das Merkelzellkarzinom sei, vermutet die wissenschaftliche Öffentlichkeit heute, dass das Virus die meisten, wenn nicht alle Merkelzelltumoren verursacht. Das Virus ist, wenn vorhanden, monoklonal in den Tumor integriert, d. h., die spätere Tumorstammzelle wurde vor ihrer krebsartigen Vermehrung befallen. Mutationen des T-Antigens heben die Infektiosität des Virus auf, es kann also nicht als Nebeninfektion (passenger virus) den schon entwickelten Tumor infiziert haben. Schließlich wird das T-Antigen-Onkogen in allen Tumorzellen exprimiert, und wenn es mittels RNAi gehemmt wird, sterben die MCPyV-positiven Zellen. MCPyV-positive Tumoren brauchen das Virus also zum Wachstum. Wahrscheinlich tragen andere Mutationen der Wirtszelle dazu bei, den Tumor letztendlich auszulösen. Das Merkelzellkarzinom ist mit Belastung durch UV- und ionisierende Strahlung assoziiert, und wahrscheinlich erhöhen diese Mutagene die Mutationsrate entweder im Virus oder im Genom der Merkelzelle und tragen so nach der Infektion zum Krebsrisiko bei.
Es bleibt völlig offen, warum 20 % der Merkelzellkarzinome virusnegativ sind. Man spekuliert unter anderem, beim Merkelzellkarzinom könnte es sich in Wirklichkeit um zwei oder mehr eng verwandte Krebsarten handeln, nur eine davon mit MCPyV-Infektion. Fehldiagnosen der schwierigen Krebsentität könnten für einige der negativen Resultate verantwortlich sein. Nur ein kleiner Anteil der mit MCV infizierten Personen entwickelt den Krebs. Gegenwärtig gibt es keinen allgemein zugänglichen Test für das Virus, und keine Änderung der empfohlenen Behandlung aufgrund eines bekannten MCPyV-Infektionsstatus. MCC-Patienten können an Studien teilnehmen, von denen sie aber vermutlich keinen persönlichen Nutzen haben werden.[30] Sonnenschutzmaßnahmen reduzieren die UV-Exposition und reduzieren vermutlich das Erkrankungsrisiko für MCC ebenso wie für andere Hautkrebsformen.
Moore hat vorgeschlagen, dass man mit den Informationen über das Virus, falls sie korrekt sind, einen Bluttest oder eine Impfung entwickeln könne, um die Behandlung der Erkrankung zu verbessern oder ihr vorzubeugen, so wie der HPV-Impfstoff dem Zervixkarzinom vorbeuge. Chang erklärte, das Studium des MCPyV helfe vielleicht, auch andere Krebsarten besser zu verstehen: „Wenn das Virus einmal integriert ist, könnte es ein Onkoprotein erzeugen, oder es könnte ein Gen ausschalten, welches Tumorwachstum hemmt. Wie auch immer, die Resultate werden jedenfalls interessant sein.“[31][32]
Quellen und Einzelnachweise
- ICTV: ICTV Taxonomy history: Human polyomavirus 1, EC 51, Berlin, Germany, July 2019; Email ratification March 2020 (MSL #35)
- H. Feng, M. Shuda, Y. Chang, P. S. Moore: Clonal Integration of a Polyomavirus in Human Merkel Cell Carcinoma. In: Science. 319, Nr. 5866, 2008, S. 1096–1100. doi:10.1126/science.1152586. PMID 18202256. PMC 2740911 (freier Volltext).
- Jaime M. Kean, Suchitra Rao, Michael Wang, Robert L. Garcea, Walter J. Atwood: Seroepidemiology of Human Polyomaviruses. In: PLoS Pathogens. 5, Nr. 3, 2009, S. e1000363. doi:10.1371/journal.ppat.1000363. PMID 19325891. PMC 2655709 (freier Volltext).
- Yanis L. Tolstov, Diana V. Pastrana, Huichen Feng, Jürgen C. Becker, Frank J. Jenkins, Stergios Moschos, Yuan Chang, Christopher B. Buck: Human Merkel cell polyomavirus infection II. MCV is a common human infection that can be detected by conformational capsid epitope immunoassays. In: International Journal of Cancer. 125, Nr. 6, 2009, S. 1250–1256. doi:10.1002/ijc.24509. PMID 19499548. PMC 2747737 (freier Volltext).
- cdc.gov
- cdc.gov
- M. Shuda, H. Feng, H. J. Kwun, S. T. Rosen, O. Gjoerup, P. S. Moore, Y. Chang: T antigen mutations are a human tumor-specific signature for Merkel cell polyomavirus. In: Proceedings of the National Academy of Sciences. 105, Nr. 42, 2008, S. 16272–7. doi:10.1073/pnas.0806526105. PMID 18812503. PMC 2551627 (freier Volltext).
- jvi.asm.org
- ICTV: Polyomaviridae, ICTV Report, Juni 2017, Revision vom Juli 2018.
- M. Pawlita, A. Clad, H. zur Hausen: Complete DNA sequence of lymphotropic papovavirus: prototype of a new species of the polyomavirus genus. In: Virology. 143, Nr. 1, Mai 1985, S. 196–211. doi:10.1016/0042-6822(85)90108-4. PMID 2998001.
- Archivierte Kopie (Memento des Originals vom 21. Januar 2010 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- Toker C: Trabecular carcinoma of the skin. In: Archives of Dermatology. 105, Nr. 1, Januar 1972, S. 107–10. doi:10.1001/archderm.105.1.107. PMID 5009611.
- S. M. Maricich, S. A. Wellnitz, A. M. Nelson, D. R. Lesniak, G. J. Gerling, E. A. Lumpkin, H. Y. Zoghbi: Merkel Cells are Essential for Light Touch Responses. In: Science. 324, Nr. 5934, 2009, S. 1580–1582. doi:10.1126/science.1172890. PMID 19541997. PMC 2743005 (freier Volltext).
- Christopher K. Bichakjian, Lori Lowe, Christopher D. Lao, Howard M. Sandler, Carol R. Bradford, Timothy M. Johnson, Sandra L. Wong: Merkel cell carcinoma: Critical review with guidelines for multidisciplinary management. In: Cancer. 110, Nr. 1, 2007, S. 1–12. doi:10.1002/cncr.22765. PMID 17520670.
- R. H. Williams, M. B. Morgan, I. M. Mathieson, H. Rabb: Merkel cell carcinoma in a renal transplant patient: increased incidence?. In: Transplantation. 65, Nr. 10, Mai 1998, S. 1396–1397. doi:10.1097/00007890-199805270-00019. PMID 9625025.
- E. Engels, M. Frisch, J. Goedert, R. Biggar, R. Miller: Merkel cell carcinoma and HIV infection. In: The Lancet. 359, Nr. 9305, 2002, S. 497–498. doi:10.1016/S0140-6736(02)07668-7. PMID 11853800.
- Ahmad Kassem, Anja Schöpflin, Carlos Diaz, Wolfgang Weyers, Elmar Stickeler, Martin Werner, Axel Zur Hausen: Frequent Detection of Merkel Cell Polyomavirus in Human Merkel Cell Carcinomas and Identification of a Unique Deletion in the VP1 Gene. In: Cancer Research. 68, Nr. 13, 2008, S. 5009–5013. doi:10.1158/0008-5472.CAN-08-0949. PMID 18593898.
- Jürgen C Becker, Roland Houben, Selma Ugurel, Uwe Trefzer, Claudia Pföhler, David Schrama: MC Polyomavirus Is Frequently Present in Merkel Cell Carcinoma of European Patients. In: Journal of Investigative Dermatology. 129, Nr. 1, 2008, S. 248–250. doi:10.1038/jid.2008.198. PMID 18633441.
- Huichen Feng, Hyun Jin Kwun, Xi Liu, Ole Gjoerup, Donna B. Stolz, Yuan Chang, Patrick S. Moore: Cellular and Viral Factors Regulating Merkel Cell Polyomavirus Replication. In: PLOS ONE. 6, Nr. 7, 2011, S. e22468. doi:10.1371/journal.pone.0022468. PMID 21799863.
- Rachel M. Schowalter, Diana V. Pastrana, Katherine A. Pumphrey, Adam L. Moyer, Christopher B. Buck: Merkel Cell Polyomavirus and Two Previously Unknown Polyomaviruses Are Chronically Shed from Human Skin. In: Cell Host & Microbe. 6, Nr. 6, 2010, S. 509–515. doi:10.1016/j.chom.2010.05.006. PMID 20542254.
- R. P. Viscidi, K. V. Shah: CANCER: A Skin Cancer Virus?. In: Science. 319, Nr. 5866, 2008, S. 1049–1050. doi:10.1126/science.1155048. PMID 18292327.
- Masahiro Shuda, Reety Arora, Hyun Jin Kwun, Huichen Feng, Ronit Sarid, María-Teresa Fernández-Figueras, Yanis Tolstov, Ole Gjoerup: Human Merkel cell polyomavirus infection I. MCV T antigen expression in Merkel cell carcinoma, lymphoid tissues and lymphoid tumors. In: International Journal of Cancer. 125, Nr. 6, 2009, S. 1243–1249. doi:10.1002/ijc.24510. PMID 19499546.
- Roland Houben, David Schrama, Miriam Alb, Claudia Pföhler, Uwe Trefzer, Selma Ugurel, Jürgen C. Becker: Comparable expression and phosphorylation of the retinoblastoma protein in Merkel cell polyoma virus positive and negative Merkel cell carcinoma. In: International Journal of Cancer. 126, Nr. 3, 2009, S. 796–798. doi:10.1002/ijc.24790. PMID 19637243.
- Klaus J. Busam, Achim A. Jungbluth, Natasha Rekthman, Daniel Coit, Melissa Pulitzer, Jason Bini, Reety Arora, Nicole C. Hanson: Merkel Cell Polyomavirus Expression in Merkel Cell Carcinomas and Its Absence in Combined Tumors and Pulmonary Neuroendocrine Carcinomas. In: The American Journal of Surgical Pathology. 33, Nr. 9, 2009, S. 1378–1385. doi:10.1097/PAS.0b013e3181aa30a5. PMID 19609205.
- H. Sihto, H. Kukko, V. Koljonen, R. Sankila, T. Bohling, H. Joensuu: Clinical Factors Associated With Merkel Cell Polyomavirus Infection in Merkel Cell Carcinoma. In: Journal of the National Cancer Institute. 101, Nr. 13, 2009, S. 938–945. doi:10.1093/jnci/djp139. PMID 19535775.
- Y Chang, E Cesarman, M. Pessin, F Lee, J Culpepper, D. Knowles, P. Moore: Identification of herpesvirus-like DNA sequences in AIDS-associated Kaposi's sarcoma. In: Science. 266, Nr. 5192, 1994, S. 1865–1869. doi:10.1126/science.7997879. PMID 7997879.
- H. Feng, J. L. Taylor, P. V. Benos, R. Newton, K. Waddell, S. B. Lucas, Y. Chang, P. S. Moore: Human Transcriptome Subtraction by Using Short Sequence Tags To Search for Tumor Viruses in Conjunctival Carcinoma. In: Journal of Virology. 81, Nr. 20, 2007, S. 11332–11340. doi:10.1128/JVI.00875-07. PMID 17686852. PMC 2045575 (freier Volltext).
- Xavier Sastre-Garau, Martine Peter, Marie-FrançOise Avril, Hélène Laude, Jérôme Couturier, Flore Rozenberg, Anna Almeida, FrançOise Boitier: Merkel cell carcinoma of the skin: pathological and molecular evidence for a causative role of MCV in oncogenesis. In: The Journal of Pathology. 218, Nr. 1, 2009, S. 48–56. doi:10.1002/path.2532. PMID 19291712.
- Christopher B. Buck, Douglas R. Lowy: Getting Stronger: The Relationship Between a Newly Identified Virus and Merkel Cell Carcinoma. In: Journal of Investigative Dermatology. 129, Nr. 1, 2009, S. 9–11. doi:10.1038/jid.2008.302. PMID 19078983.
- New Pathogen Discovery:Frequently Asked Questions. KSHV laboratory, molecular virology program, University of Pittsburgh Cancer Institute. Archiviert vom Original am 22. April 2008. Abgerufen am 13. April 2008.
- Newly Discovered Virus Linked To Deadly Skin Cancer, University of Pittsburgh Medical Center News Bureau, 17. Januar 2007 auf sciencedaily.com
- Allison Gandey: newly discovered virus linked to neuroendocrine cancer of the skin. MedScape Medical News. 18. Januar 2008. Abgerufen am 28. Mai 2012.