Melittin
Melittin (von griech. μέλιττα mélitta – die Biene) bezeichnet ein als Hauptbestandteil (50–70 %)[1] im Bienengift enthaltenes kationisches Polypeptid, bestehend aus 26 Aminosäuren.[2] Homologe Peptide wurden in anderen Stechimmen-Gattungen gefunden, darunter Kurzkopfwespen (Vespula),[3] Hornissen (Vespa)[4] und Feldwespen der Gattung Polistes.[5] Melittin ist ein porenbildendes Toxin.
| Melittin | ||
|---|---|---|
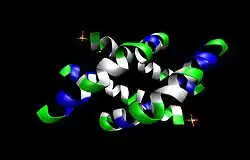
| ||
| Bänderdarstellung des biologisch aktiven Homotetramers | ||
| Masse/Länge Primärstruktur | 26 AS (Monomer) | |
| Sekundär- bis Quartärstruktur | Homotetramer | |
| Präkursor | Propeptid (48 AS) | |
| Bezeichner | ||
| Gen-Name(n) | MELT | |
| Externe IDs | ||
| Transporter-Klassifikation | ||
| TCDB | 1.C.18.1.1 | |
| Bezeichnung | Melittin-Familie | |
| Vorkommen | ||
| Übergeordnetes Taxon | Stechimmen (Aculeata) | |
Struktur und Funktion
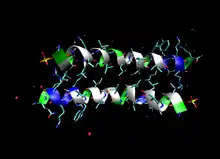
Die Primärstruktur des Monomers besteht aus 26 Aminosäuren; es hat eine Molekülmasse von 2848 Da.[6][7]
Der Aufbau ähnelt dem eines Tensids: 19 der 20 Aminosäuren am N-Terminus sind unpolar, die sechs Aminosäuren am C-Terminus des Proteins sind polar. Es ist trotz des überwiegenden Anteils an unpolaren Aminosäuren in Wasser als Tetramer löslich, das heißt jeweils vier der Proteine bilden eine Einheit, die in Wasser löslich ist.[8]
Melittin lagert sich in Zellmembranen ein und bildet dort Kanäle, die für gelöste Ionen durchlässig sind. Die Durchlässigkeit ist dabei für Anionen höher als die für Kationen.[8] Es wird davon ausgegangen, dass dies durch eine parallele Anordnung des Melittins in der Zellmembran als Tetramer geschieht, das heißt, im Gegensatz zum Tetramer in Wasser zeigen alle Proteine in die gleiche Richtung.[9]
Die Ionendurchlässigkeit der Zellmembran führt in Folge zur Freisetzung von Kaliumionen und damit schließlich zu Zelltod, Mastzellzerfall und Gefäßerweiterung.
Weblinks
Einzelnachweise
- Stanley D. Somerfield, Jean-Louis Stach et al.: Bee venom melittin blocks neutrophil O2− production. In: Inflammation, Bd. 10, Nr. 2, 1986, S. 175–182 doi:10.1007/BF00915999.
- Magdalena T. Tosteson, Daniel C. Tosteson: The sting. Melittin forms channels in lipid bilayers. In: Biophysical Journal, Bd. 36, Nr. 1, 1981, S. 109–116, PMID 6269667, PMC 1327579 (freier Volltext).
- UniProt P59262
- UniProt P68409
- UniProt P59261
- Primärstruktur des Monomers: Gly-Ile-Gly-Ala-Val-Leu-Lys-Val-Leu-Thr-Thr-Gly-Leu-Pro-Ala-Leu-Ile-Ser-Trp-Ile-Lys-Arg-Lys-Arg-Gln-Gln
- UniProt P01501
- Thomas C. Terwilliger, David Eisenberg: The Structure of Melittin. I. Structure determination and partial refinement. In: The Journal of Biological Chemistry. Bd. 257, Nr. 11, S. 6010–6015, 1982, PMID 7076661 (Digitalisat).
- Horst Vogel, Fritz Jähnig: The structure of melittin in membranes. In: Biophysical Journal, Bd. 50, Nr. 4, 1986, S. 573–582, PMID 3779000; PMC 1329835 (freier Volltext).