Mangan(II)-carbonat
Mangan(II)-carbonat ist eine chemische Verbindung aus der Gruppe der Manganverbindungen und Carbonate.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
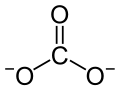 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Mangan(II)-carbonat | ||||||||||||||||||
| Andere Namen |
Mangancarbonat (mehrdeutig) | ||||||||||||||||||
| Summenformel | MnCO3 | ||||||||||||||||||
| Kurzbeschreibung |
farbloser bis hellbrauner geruchloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 114,95 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
3,12 g·cm−3 (Monohydrat)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−894,1 kJ/mol[3] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Vorkommen
Natürlich kommt Mangan(II)-carbonat als Mineral Rhodochrosit vor.
Gewinnung und Darstellung
Mangan(II)-carbonat kann durch Reaktion von gelösten Mangan(II)-Salzen mit alkalischen Carbonaten (z. B. Reaktion von Mangansulfat mit Ammoniumcarbonat gewonnen werden).[4]
Eigenschaften
Mangan(II)-carbonat ist ein in reinem Zustand farbloser, leicht oxidiert bereits ein hellbrauner (als Mineral rosa bis roter) geruchloser Feststoff. Ab einer Temperatur von 200 °C zersetzt es sich, wobei Manganoxide und Kohlendioxid frei werden.
Verwendung
Mangan(II)-carbonat wird als Düngemittelzusatz, Zusatz zur Verbesserung der dielektrischen Eigenschaften von Bariumtitanat und zur Herstellung von Ferriten und anderen Manganverbindungen verwendet.[1] Das Monohydrat wird auch zur Färbung (lila bis violett[5]) von Keramik eingesetzt.[6]
Einzelnachweise
- Eintrag zu Mangan(II)-carbonat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 22. Dezember 2019. (JavaScript erforderlich)
- National Pollutant Inventory: Manganese & compounds, abgerufen am 17. Februar 2015.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-20.
- Martha Austin: Über die Bestimmung von Mangan als Karbonat. In: Zeitschrift für anorganische Chemie. 1898, 17 (1), S. 272–275; doi:10.1002/zaac.18980170127.
- [https://de.wikipedia.org/w/index.php?title=Wikipedia:Defekte_Weblinks&dwl=http://www.ceramicashop.de/daten/pdf/farbkoeper.pdf Seite nicht mehr abrufbar], Suche in Webarchiven: [http://timetravel.mementoweb.org/list/2010/http://www.ceramicashop.de/daten/pdf/farbkoeper.pdf Keramische Rohstoffe (ceramicashop)] (Seite nicht mehr abrufbar, Suche in Webarchiven) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis. (PDF; 110 kB)
- Mangancarbonat (Todini and Co.) (Memento des Originals vom 15. Mai 2016 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.