L-Lactatdehydrogenase
L-Lactatdehydrogenase oder kurz Lactatdehydrogenase (LDH) ist ein Enzym, das die Bildung von L-Lactat und NAD+ aus Pyruvat und NADH katalysiert. Die Reaktion ist reversibel. LDH kommt in allen Zellen nahezu aller Lebewesen vor. Sie ist ein Bestandteil der Milchsäuregärung. Bei höheren Tieren reichert sich von Zellen ausgeschiedene LDH aufgrund großer Stabilität auch in Hämolymphe und Blut an. Dort kann sie als ein Laborparameter genutzt werden, der Zellschädigungen anzeigt. Die sehr ähnliche D-Lactatdehydrogenase kommt nur bei niederen Tieren, Mikroorganismen und Pflanzen vor.[1]
| L-Lactatdehydrogenase | ||
|---|---|---|
_1I10.png.webp)
| ||
| Bändermodell LDH-5 (Muskel) nach PDB 1I10 | ||
| Masse/Länge Primärstruktur | 333/331/331 Aminosäuren | |
| Bezeichner | ||
| Gen-Name(n) | LDHA, LDHB, LDHC | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.1.1.27, Oxidoreduktase | |
| Substrat | Pyruvat + NADH + H+ | |
| Produkte | Lactat + NAD+ | |
Biochemie
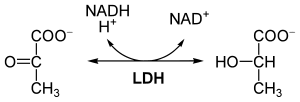
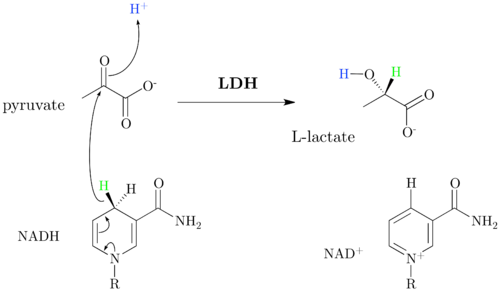
Die Reduktion des Pyruvats zu Lactat durch LDH und den Cofaktor NADH ist Merkmal der Milchsäuregärung, bei der Energie aus Glucose ohne Sauerstoffverbrauch gewonnen wird. Die Lactatbildung führt dabei dazu, NAD+ zu regenerieren, welches in der Glykolyse von GAPDH benötigt wird. Lactat selbst ist im Gärungsprozess nicht weiter nutzbar und wird von der Zelle an das Blut oder von Zelle zu Zelle weitergegeben. Bei Menschen und höheren Tieren wird Lactat über den Blutstrom in die Leber transportiert. Dort läuft in Gegenwart von NAD+ die umgekehrte Reaktion ab. Lactat wird dabei zu Pyruvat oxidiert und ist dem Stoffwechsel somit wieder zugänglich. Die Reaktion läuft auch in einigen Muskelgeweben ab, sofern NAD+ verfügbar ist.
Die Reduktion von Pyruvat zu Lactat ist stark exergon (ΔG0’ = –25 kJ/mol).
Isoformen
Im menschlichen Körper findet man verschiedene Isoenzyme der LDH. Die LDH besteht immer aus vier Untereinheiten.
Die klassischen sind die fünf Formen LDH-1 bis LDH-5, die sich aus den Untereinheiten LDH-H und/oder LDH-M aufbaut. Je nach Art der Zusammensetzung aus diesen zwei Typen ergeben sich fünf mögliche Kombinationen. Im Folgenden sind die im jeweiligen Organ vorherrschenden Isoenzyme angegeben:
- LDH-1 (4H) – im Herz, Erythrozyten und Niere
- LDH-2 (3H1M) – in Erythrozyten, Niere, Herz und Lunge
- LDH-3 (2H2M) – in den Zellen der Lunge, Thrombozyten und lymphatisches System
- LDH-4 (1H3M) – in verschiedenen Organen
- LDH-5 (4M) – innerhalb der Leber und der Quergestreiften Muskulatur
Zu beachten ist, dass in den genannten Organen auch andere LDH-Isoenzyme vorkommen, so ist im Herz auch LDH-2 (und in Spuren LDH-3) zu finden; LDH-1 ist die vorherrschende Form.
Seit der Identifikation der klassischen LDH-Untereinheiten in den 1950er Jahren wurden weitere LDH-Isoenzyme entdeckt, die ebenfalls als Tetramere vorliegen: In den 1960er Jahren wurde LDHC entdeckt. Es ist vornehmlich aus LDHC-Untereinheiten aufgebaut und wird nur im Hoden exprimiert. In den 2010er Jahren wurde LDHBx entdeckt. LDHBx ist eine Peroxisom-spezifische Untereinheit. LDHBx entsteht während der Translation der LDHB-mRNA, aber das Stopcodon wird als ein Aminosäure-kodierendes Codon interpretiert. Daher geht die Translation bis zum nächsten Stopcodon weiter. Das führt dazu, dass die LDHBx sieben Aminosäuren länger als das klassische LDH-H (LDHB)-Protein ist. Die entstandene Verlängerung enthält eine peroxisomale Signalsequenz, so dass LDHBx ins Peroxisom importiert wird.[2]
Labordiagnostik
Die Lactatdehydrogenase (LDH) wird als diagnostischer Parameter genutzt, um erhöhte Schädigungen von Zellen nachzuweisen. Lysierende Zellen setzen das Enzym frei. Aufgrund großer Stabilität verbleibt LDH im Extrazellularraum und reichert sich bei pathologischen Zellschädigungen im Blut an. Darin bzw. im Plasma/Serum wird die LDH-Aktivität gemessen. Unter physiologischen Bedingungen beträgt die Serumaktivität der LDH bis zu 240 U/l. Steigt sie über diesen Wert, ist dies auf verstärkten Zerfall von Zellen zurückzuführen. Anhand der Bestimmung der LDH-Isoenzyme ist außerdem nachvollziehbar, welchem Organ die Herkunft der Enzymerhöhung zuzuschreiben ist. Innerhalb des Blutserums lassen sich alle Isoformen der LDH nachweisen, wobei LDH-1 und -2 überwiegen. Eine Erhöhung von LDH-1 und LDH-2 kann einen verstärkten Zelltod von Herzmuskelzellen oder Blutzellen anzeigen, dagegen würde eine Erhöhung der LDH-5 vermuten lassen, dass ein Leberschaden vorliegt. Letztlich kann eine Diagnose nur in Zusammenschau mehrerer Befunde gestellt werden.
Vor allem bei hämatologischen Erkrankungen, bei Muskelerkrankungen und bei Leber- und Gallenwegserkrankungen kann ein labordiagnostischer LDH-Test Aufschluss darüber geben, welche Schäden aufgetreten sind. Früher wurde die LDH-Aktivität auch bei Herzmuskelerkrankungen bestimmt, was heute dank neuerer Messgrößen (Kardiales Troponin) zwar nicht mehr unbedingt notwendig ist, z. T. aber dennoch vorgenommen wird, insbesondere wenn es um den Nachweis eines nicht mehr frischen Herzinfarktes geht. Im Vergleich zu anderen herzmuskelspezifischen Enzymen bzw. Enzymkonstellationen bleiben LDH-1 und LDH-2 verhältnismäßig lange nachweisbar. Eingetretene Zellschäden lassen sich noch nach bis zu 20 Tagen nachweisen.
Interpretation
Da die LDH in allen Geweben vorkommt, kann bei erhöhten Werten zunächst nur die Aussage getroffen werden, dass eine Gewebeschädigung stattgefunden hat.
Am häufigsten treten erhöhte Werte im Zusammenhang mit folgenden Erkrankungen auf:[4]
- des Verdauungstraktes (z. B. Posthepatischer Ikterus aufgrund von Störungen in der Gallenblase oder im Zwölffingerdarm),
- der Leber (Hepatopathien; z. B. Hepatozellulärer Ikterus),
- des Herzens (Kardiomyopathien),
- der Skelettmuskulatur (z. B. Myositis),
- der Lunge (Vaskulopathien; Lungenembolie),
- der Niere (Nephropathien; z. B. Niereninfarkt),
- des Blutes (Anämien; z. B. Hämolyse),
- des Hormonsystems (Endokrinopathien; z. B. Hypothyreose oder Thyreoiditis),
- Systemerkrankungen (z. B. Karzinome, oder Sarkoidose, Konnektivitis oder Mononukleose).
Erniedrigte Werte findet man im Zusammenhang mit einer vorausgegangenen Radiotherapie.
Aufgrund des ubiquitären Vorkommens von LDH ist dieses Enzym und seine Isoformen nicht organspezifisch, daher dient es nicht als topographisches Leitenzym in der Diagnostik.
Fehlerursachen
LDH ist in den roten Blutkörperchen (Erythrozyten) in großer Menge vorhanden. Deshalb weisen hämolytische Blutproben unter Umständen falsch positive Testergebnisse auf, da diese Hämolyse auch in vitro durch inkorrekte Lagerung, falsche Abnahme oder langen Transport der Proben verursacht werden kann.
Bedeutung in der Forschung
In den Biowissenschaften und in der Pharmakologie wird extrazelluläre LDH als Marker für einen aufgetretenen Zellschaden verwendet, etwa bei toxikologischen Untersuchungen. Ins Medium freigesetzte LDH kann unter anderem durch deren Reaktion mit Tetrazoliumsalzen zu Formazan-Farbstoffen nachgewiesen werden.
Literatur
- B. Neumeister, I. Besenthal, H. Liebich, O. Böhm: Klinikleitfaden Labordiagnostik. Urban & Fischer, München/ Jena 2003, ISBN 3-437-22231-7.
- Lothar Thomas: Labor und Diagnose. TH-Books, Frankfurt am Main 2005, ISBN 3-9805215-5-9.
Weblinks
- ExPASy.org: LDH
- David Goodsell: Molecule of the Month: Lactate Dehydrogenase
Einzelnachweise
- BRENDA - Information on EC 1.1.1.28 - D-lactate dehydrogenase.
- F. Schueren, T. Lingner, R. George, J. Hofhuis, J. Gartner, S. Thoms: Peroxisomal lactate dehydrogenase is generated by translational readthrough in mammals. In: eLife. Band 3, 2014, S. e03640, doi:10.7554/eLife.03640, PMID 25247702.
- IFCC
- Philippe Furger: ’Labor quick’ - Laborwerte und Laborbefunde von A–Z, Differenzialdiagnose, Labormedizin. 2. Auflage. Thieme 2014, ISBN 978-3-13-147522-0, S. 87.