Jourdan-Ullmann-Reaktion
Die Jourdan-Ullmann-Reaktion ist eine Namensreaktion der organischen Chemie, bei der ein Arylhalogenid unter Kupferkatalyse mit einem Anilin oder Anilinderivat zu einem Diarylamin umgesetzt wird.[1] Die Reaktion wurde erstmals 1885 von Friedrich Jourdan beschrieben[2] und ab 1902 von Fritz Ullmann und seiner Assistentin und späteren Ehefrau Irmi Goldberg erweitert.[3][4]
Die Reaktion wird auch als Ullmann-Reaktion, Ullmann-Kondensation oder Ullmann-Goldberg-Kondensation bezeichnet.
Reaktion
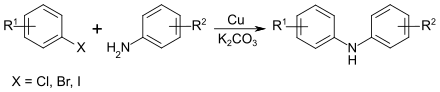
Die Reaktivität der Arylhalogenide bei der Jourdan-Ullmann-Reaktion wird durch elektronenziehende Substituenten erhöht, wobei die Reaktivität der Halogenide in der Reihe I > Br > Cl > F abnimmt. Die Reaktion wird durch elementares Kupfer in Gegenwart von Sauerstoff, aber auch durch Kupfersalze, wie Kupfer(II)-acetat und Kupfer(I)-iodid katalysiert. Entscheidend ist die Gegenwart einer Base, wie z. B. Kaliumcarbonat, um den entstehenden Halogenwasserstoff zu neutralisieren.[1] Die Reaktion kann sowohl in hochsiedenden aprotischen Lösungsmitteln (z. B. Nitrobenzol, DMSO) als auch in Wasser durchgeführt werden.[5][6]
Reaktionsmechanismus
Ein möglicher Reaktionsmechanismus für die Jourdan-Ullmann-Reaktion ist eine nukleophile aromatische Substitution des Halogens durch das aromatische Amin. Alternativ wird auch ein Prozess über ein freies Radikal, das durch die reduktive Dehalogenierung des Arylhalogenids mit Kupfer entsteht, diskutiert.[1]
Anwendung
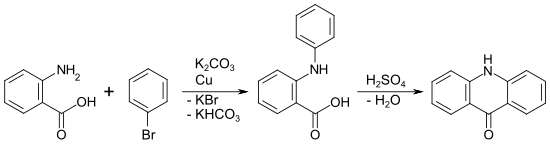
Anwendung findet die Jourdan-Ullmann-Reaktion bei der Synthese von Acridon. Im ersten Schritt werden Anthranilsäure und Brombenzol in Gegenwart von Kupfer und Kaliumcarbonat zur Phenylanthranilsäure kondensiert. Die Phenylanthranilsäure cyclisiert mit Schwefelsäure zu Acridon.[7]
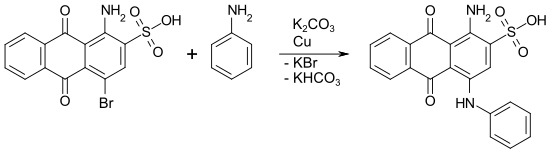
Die Jourdan-Ullmann-Reaktion ist die wichtigste industrielle Methode, um Arylamino-Substituenten in das Anthrachinon-Gerüst einzuführen. Dies ist der zentrale Reaktionsschritt bei der Produktion vieler blauer und grüner Direktfarbstoffe, Säurefarbstoffe und Reaktivfarbstoffe ausgehend von der Bromaminsäure (1-Amino-4-brom-9,10-anthrachinon-2-sulfonsäure).[6]
Beispiel: Synthese von C.I. Acid Blue 25 durch Umsetzung von Bromaminsäure mit Anilin
Verwandte Reaktionen
- Synthese von Diarylether durch Umsetzung von Arylhalogeniden mit Phenolen unter Kupferkatalyse (Ullmann-Diarylethersynthese)
- Synthese von Biarylen aus Arylhalogeniden unter Kupferkatalyse (Ullmann-Reaktion)
Einzelnachweise
- Zerong Wang: Comprehensive Organic Name Reactions and Reagents. John Wiley & Sons, Inc., Hoboken, New Jersey 2009, ISBN 978-0-471-70450-8, S. 1569–1575.
- Friedrich Jourdan: Neue Synthesen von Derivaten des Hydroacridins und Acridins. In: Berichte der deutschen chemischen Gesellschaft. Band 18, Nr. 1, Januar 1885, S. 1444, doi:10.1002/cber.188501801312.
- F. Ullmann: Ueber eine neue Bildungsweise von Diphenylaminderivaten. In: Berichte der deutschen chemischen Gesellschaft. Band 36, Nr. 2, April 1903, S. 2382, doi:10.1002/cber.190303602174.
- Irma Goldberg: Ueber Phenylirungen bei Gegenwart von Kupfer als Katalysator. In: Berichte der deutschen chemischen Gesellschaft. Band 39, Nr. 2, März 1906, S. 1691, doi:10.1002/cber.19060390298.
- Chao-Hun Li, Tak-Hang Chan: Comprehensive Organic Reactions in Aqueous Media. 2. Auflage. John Wiley & Sons, Inc., Hoboken, New Jersey 2007, ISBN 978-0-471-76129-7, S. 163.
- Heinrich Zollinger: Color Chemistry: Syntheses, Properties, and Applications of Organic Dyes and Pigments. 3. Auflage. WILEY-VCH Verlag, Weinheim 2003, ISBN 3-906390-23-3, S. 274 (eingeschränkte Vorschau in der Google-Buchsuche).
- Werner Kunz, Eberhard Nonnenmacher: Reaktionen der organischen Chemie. 6. Auflage. Wiley-VHC, Weinheim 1997, S. 18 (eingeschränkte Vorschau in der Google-Buchsuche).