Guggenheim-Quadrat
Das Guggenheim-Quadrat oder Guggenheim-Schema (nach Edward Guggenheim) ist ein Hilfsmittel, um einige einfache, aber grundlegende Beziehungen der Thermodynamik, wie die charakteristischen Funktionen oder die Maxwell-Beziehungen, aus dem Gedächtnis heraus aufzustellen.

Verknüpft werden die thermodynamischen Potentiale
an den Kantenmitten
mit den Zustandsgrößen
an den Ecken des Quadrats.
Verwendung
Charakteristische Funktionen
Um die charakteristische Funktion, also das totale Differential eines der vier thermodynamischen Potentiale , , , , zu erhalten, ist wie folgt vorzugehen:
- Auswahl eines thermodynamischen Potentials; für die Relation des großkanonischen Potentials bietet sich der Vergleich zur sehr ähnlichen freien Energie an.
- Beispiel: Wir suchen das totale Differential der inneren Energie , also
- Die beiden Symbole, die dem gesuchten Potential in den Ecken gegenüberliegen, stellen die Koeffizienten derjenigen Differentiale dar, die sich an den Ecken neben dem gesuchten Potential befinden.
- Im Beispiel liegen an den gegenüberliegenden Ecken von der Druck und die Temperatur . Das vorläufige Zwischenergebnis ist damit
- Das zu gehörige Differential befindet sich in der diagonal gegenüberliegenden Ecke und ist damit das Volumen ; Zwischenergebnis:
- Analog zum vorigen Schritt befindet sich diagonal gegenüber als zugehöriges Differential die Entropie ; Zwischenergebnis:
- Alle Koeffizienten, die sich auf der linken Seite des Quadrates befinden, erhalten ein negatives Vorzeichen.
- Da sich auf der linken Seite des Vierecks befindet, erhält es ein negatives Vorzeichen. Zwischenergebnis: . ( liegt zwar auch links, es kommt aber nur als Differential und nicht als Koeffizient vor und erhält daher kein negatives Vorzeichen. Analog ist bei der Suche nach kein negatives Vorzeichen vor den -Term zu stellen, da es sich auch hier nicht um einen Koeffizienten handelt.)
- Zum Schluss wird stets noch der Term für das chemische Potential (mit der Teilchenzahl ) addiert.
- Im Beispiel ergibt sich so das Endergebnis
Maxwell-Relationen
- Auszuwählen sind zwei Zustandsgrößen, die an den beiden Ecken einer gemeinsamen Seite des Quadrates liegen.
- Beispiel: Gesucht ist eine Maxwell-Relation mit und , welche die Ecken der linken Kante bilden. Diese bilden den Differentialquotienten der linken Seite der gesuchten Maxwell-Relation, also
- Die Zustandsgrößen, welche die gegenüberliegende Seite des Quadrats begrenzen, bilden den Differentialquotienten auf der rechten Seite der gesuchten Maxwellgleichung. Dabei ist darauf zu achten, dass sie in gleicher Richtung abgelesen werden wie die erste Kante.
- Gegenüber von und befinden sich und . Wir haben gebildet, also "obere Ecke nach unterer Ecke abgeleitet". Dementsprechend muss auch auf der anderen Seite des Quadrats "von oben nach unten" abgeleitet werden. Zwischenergebnis ist also . (Analoges ergibt sich für links/rechts, etwa bei der Suche nach ).
- Differentialquotienten, die sowohl als auch enthalten, erhalten ein negatives Vorzeichen, da beide(!) Symbole an der Kante mit dem Minuszeichen liegen.
- Die linke Seite erhält demnach ein negatives Vorzeichen. Das Zwischenergebnis ist also
- Die konstant gehaltene Variable einer Seite ist stets im Nenner der anderen Seite wiederzufinden.
- Das Endergebnis ist also
Zustandsgröße als Differentialquotient
- Auszuwählen ist eine Größe, die in einer Ecke des Quadrates liegt.
- Beispiel: Gesucht sind Beschreibungen von als Differentialquotient bzw. Ableitung. liegt an der linken Seite des Quadrats, also
- Das der Größe diagonal gegenüber liegende Symbol stellt den Nenner der Ableitungen dar.
- Gegenüber von liegt , also
- Die beiden dem Nenner benachbarten Symbole bilden jeweils den Zähler einer Ableitung.
- Benachbart zu liegen und , also gilt und
- Das dritte Symbol an den Seiten von Zähler und Nenner ist jeweils die Größe, die konstant bleibt.
- An der Seite von und liegt , also gilt ; an der Seite von und liegt , also gilt
- (Auch hier erhalten Größen, die zwar auf der linken Seite liegen, aber nur im Differentialquotienten vorkommen, kein negatives Vorzeichen!)
Im Gleichgewicht minimierte Zustandsgröße
- Auszuwählen sind zwei benachbarte Ecken des Guggenheim-Quadrates, welche bei dem Prozess kontrolliert, also konstant gehalten werden.
- Beispiel: Entropie und Druck sollen konstant gehalten werden, also wurden die linksseitigen Ecken ausgewählt.
- Die im Gleichgewicht minimierte Größe steht nun zwischen den gewählten Ecken.
- Im Beispiel gilt also
Merksprüche
Zur einfacheren Anwendung sei folgende beispielhafte Auswahl an mehrheitlich humoristischen Merksprüchen angegeben, welche auf jeweils unterschiedliche Art und Weise gelesen die Buchstabenreihenfolge des Quadrats wiedergeben:
- Seid heute pünktlich, unten gibt's viele frische Tomaten.
- Schnell und viel hilft für Prüfungen Guggenheims Tat.
- Schon unter Varus hatten früher/alle praktische(n) Germanen Taschenrechner.
- Good physicists have studied under very fine teachers.
- Unheimlich viele Forscher trinken gerne Pils hinterm Schreibtisch.
- Gute Physiker haben stets/selten eine Vorliebe für Thermodynamik.
- Prinzipiell haben schon unsere Vorfahren für Thermodynamik geschwärmt.
- SUV-Fahrer tragen gerne pinke Hemden.
Neben diesen Merksprüchen existieren zahlreiche weitere.
Merkhilfen für drei Freiheitsgrade
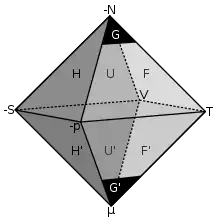
Das Guggenheim-Quadrat beschreibt Systeme mit zwei Freiheitsgraden. Für drei Freiheitsgrade wurden Merkhilfen in Form der geometrischen Figuren Oktaeder[1][2] und Kuboktaeder[3] beschrieben. Bei diesen sind, im Gegensatz zum Quadrat, die thermodynamischen Potentiale (G, U, H, F etc.) keine Kanten, sondern Flächen.
Weblinks
- The Guggenheim scheme. (Nicht mehr online verfügbar.) Archiviert vom Original am 24. Juli 2007; abgerufen am 15. September 2011 (englisch).
Literatur
- Jibamitra Ganguly: Thermodynamics in earth and planetary sciences. 2009, ISBN 978-3-540-77306-1, Thermodynamic Square: A Mnemonic Tool, S. 59–60 (eingeschränkte Vorschau in der Google-Buchsuche).
- Wedler, Gerd: Lehrbuch der Physikalischen Chemie. 2. Auflage. VCH, 1985, ISBN 3-527-29481-3, 2.3.2 - Charakteristische thermodynamische Funktionen, S. 252–256.
Einzelnachweise
- L. T. Klauder, American Journal of Physics, 1968, 36(6), 556–557 doi:10.1119/1.1974977
- James M. Phillips, J. Chem. Educ., 1987, 64(8), 674–675 doi:10.1021/ed064p674
- Ronald. F. Fox, J. Chem. Educ., 1976, 53(7), 441–442 doi:10.1021/ed053p441