Charakteristische Funktion (Physik)
Die charakteristischen Funktionen[1] (auch charakteristische Potentialformen genannt) bezeichnen in der Thermodynamik die totalen Differentiale (Änderungen) der thermodynamischen Potentiale.
Totale Differentiale
Der inneren Energie
Aus dem Ersten und Zweiten Hauptsatz der Thermodynamik wird folgende Fundamentalgleichung für die innere Energie U hergeleitet:
Dabei ist S die Entropie, V das Volumen, T die absolute Temperatur und p der Druck. steht für die Stoffmenge und für das chemische Potential der Komponente .
Der Enthalpie
Aus der Definition der Enthalpie H
folgt wegen :
und mit der Fundamentalgleichung erhält man
und damit die charakteristische Funktion:
Der Gibbs-Energie
Aus der Definition der Gibbs-Energie (freien Enthalpie) G
folgt ferner
und damit die charakteristische Funktion
Des Großkanonischen Potentials
Schließlich folgt aus der Definition des Großkanonischen Potentials für Einstoffsysteme:
dass
Guggenheim-Schema
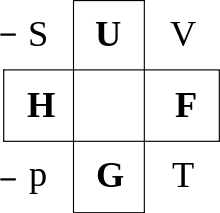
Zum praktischen Arbeiten kann man das Guggenheim-Quadrat benutzen. Hieraus erhält man alle oben genannten charakteristischen Funktionen bis auf die des Großkanonischen Potentials, welche aber sehr ähnlich der der Freien Energie ist.
Man findet die Relation, indem man das totale Differential aus der Mitte einer der vier Seiten des Schemas entnimmt und dann aus den gegenüberliegenden Ecken sowie den zwei benachbarten Feldern die rechte Seite abliest. Am Ende muss man stets den Summanden hinzufügen.
Zum Beispiel entnimmt man aus der oberen Seite, woraus das totale Differential der linken Seite der Gleichung folgt. Schräg gegenüber liegt dann beispielsweise und von diesem wiederum diagonal gegenüber , was zum Ausdruck führt. Analog erhält man den Summanden mit der Besonderheit, dass, wenn der Koeffizient des Summanden auf der linken Seite des Quadrats liegt, ein negatives Vorzeichen vorangestellt wird. Dies gilt jedoch nur für Koeffizienten. Es ergibt sich damit wie oben erwähnt
- .
Merksprüche für das Quadrat finden sich unter: Guggenheim-Quadrat (Merksprüche)
Einzelnachweise
- Rolf Haase: Thermodynamik. Springer-Verlag, 2013, ISBN 978-3-642-97761-9 (google.de [abgerufen am 15. Dezember 2020]).