Fructose-2,6-bisphosphat
Fructose-2,6-bisphosphat (F-2,6-BP) ist ein zweifach phosphorylierter Zucker (Fructose), der in der Regulation der Glykolyse und Gluconeogenese eine wichtige Rolle spielt, indem er die Aktivität der Enzyme Phosphofructokinase (PFK1) und Fructose-1,6-bisphosphatase (FBPase1) allosterisch kontrolliert.[2]
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
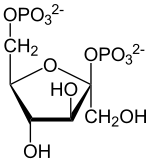 | ||||||||||
| β-D-Fructose-2,6-bisphosphat | ||||||||||
| Allgemeines | ||||||||||
| Name | Fructose-2,6-bisphosphat | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C6H14O12P2 | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 340,12 g·mol−1 | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Bildung und Abbau
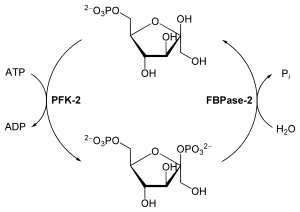
F-2,6-BP wird aus Fructose-6-phosphat gebildet, welches die Phosphofructokinase-2 (PFK-2) katalysiert. Dabei wird ATP verbraucht. Der Abbau von F-2,6-BP zu Fructose-6-phosphat und anorganischem Phosphat katalysiert die Fructose-2,6-bisphosphatase (FBPase-2). PFK-2 und FBPase-2 haben zwar unterschiedliche enzymatische Aktivitäten, bilden aber zusammen ein bifunktionelles, hormonell regulierbares Enzym, die PFKFB.[3]
Wirkung im Glucosestoffwechsel
Bei hoher physiologischer Konzentration (im Bereich von >0,1 μM[4]) ist F-2,6-BP ein wirksamer allosterischer Aktivator der Phosphofructokinase 1. Es vermag zudem die blockierende Wirkung der allosterischen Hemmer ATP und Citrat aufzuheben. Dadurch wird die Schlüsselreaktion der Glykolyse, die stark exergone Phosphorylierung von Fructose-6-phosphat zu Fructose-1,6-bisphosphat (F-1,6-BP), aktiviert. Sie läuft ohne F-2,6-BP bei üblichen physiologischen Konzentrationen der Substrate fast nicht ab.[4] Durch die Aktivierung wird die gesamte Glykolyse stimuliert. Das Produkt F-1,6-BP ist nämlich ein Aktivator der Pyruvatkinase, welches eine Folgereaktion der Glykolyse katalysiert. Dieser Regulationsmechanismus wird feedforward-Stimulierung genannt.[5]
Die Konkurrenzreaktion zur Glykolyse, die Gluconeogenese, wird von hohen F-2,6-BP-Konzentrationen dagegen wirksam unterdrückt, indem das Enzym Fructose-1,6-bisphosphatase allosterisch gehemmt wird. Durch diese reziproke Kontrolle wird verhindert, dass durch gleichzeitiges Ablaufen beider Stoffwechselwege Energie verschwendet wird.
Regulation der Konzentration
Ist der Blutzuckerspiegel niedrig, z. B. bei Nahrungskarenz, wird in der Bauchspeicheldrüse das Hormon Glucagon gebildet. In der Leber, dem Hauptorgan für die Gluconeogenese, löst Glucagon eine Signalkaskade aus, durch die die intrazelluläre cAMP-Konzentration erhöht wird. Dies aktiviert die cAMP-abhängige Proteinkinase A (PKA), welche die PFKFB phosphoryliert.[3]
Dadurch wird die PFK2-Funktion deaktiviert und die FBPase2 des bifunktionellen Enzyms aktiviert. Folglich sinkt die Konzentration an Fructose-2,6-bisphosphat, weil es durch FBPase2 zu Fructose-6-phosphat hydrolysiert wird. Das Gluconeogeneseenzym FBPase1 wird nicht mehr durch F-2,6-BP gehemmt und der Blutzucker steigt. Auch weil gleichzeitig die stimulierende Wirkung von F-2,6-BP auf die Glykolyse entfällt.
Umgekehrt entsteht bei hohem Glucosespiegel durch die ersten Schritte der Glycolyse viel Fructose-6-phosphat. Dieses wirkt als Aktivator der Phosphoproteinphosphatase, welches PFKFB dephosphoryliert. Dadurch wird die FBPase2-Aktivität ab- und die PFK2-Funktion angestellt und folglich vermehrt F-6-P zu F-2,6-BP phosphoryliert. Dies bewirkt eine Aktivierung der Glycolyse und Hemmung der Gluconeogenese und damit eine Senkung des Blutzuckers.
Literatur
- J. M. Berg, J. L. Tymoczko, L. Stryer: Stryer Biochemie. 6. Auflage. Spektrum Akademischer Verlag, München 2007, ISBN 978-3-8274-1800-5.
- David L. Nelson, Michael M. Cox: Lehninger Principles of Biochemistry. 5. Auflage. Palgrave Macmillan, 2008, ISBN 978-0-7167-7108-1, S. 587 ff.
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- C. Wu et al.: Roles for fructose-2,6-bisphosphate in the control of fuel metabolism: beyond its allosteric effects on glycolytic and gluconeogenic enzymes. In: Adv. Enzyme Regul, 2006, 46 (1), S. 72–88; PMID 16860376; doi:10.1016/j.advenzreg.2006.01.010
- IJ. Kurland, SJ. Pilkis: Covalent control of 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase: insights into autoregulation of a bifunctional enzyme. In: Protein Sci., 1995, 4(6), S. 1023–1037; PMID 7549867; PMC 2143155 (freier Volltext).
- HG. Hers, E. van Schaftingen: Fructose 2,6-bisphosphate 2 years after its discovery. In: Biochem J, 1982, 206 (1), S. 1–12; PMID 6289809; PMC 1158542 (freier Volltext).
- M. Bali, SR. Thomas: A modelling study of feedforward activation in human erythrocyte glycolysis. In: C R Acad Sci III, 2001, 324 (3), S. 185–199, PMID 11291305; doi:10.1016/S0764-4469(00)01295-6.