Flavon (chemische Verbindung)
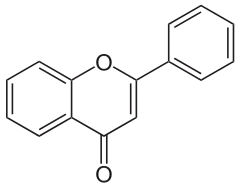
Das Flavon ist eine organische chemische Verbindung, die vom Benzopyran-4-on (Chromon) abgeleitet werden kann. Auf diesem Molekül basiert die Gruppe der Flavonoide, vor allem die Untergruppe der Flavone. Zahlreiche seiner Derivate – Flavone, Flavonole und Flavanone – sind gelbe Farbstoffe. Flavon kann auch als heterocyclisches Keton aufgefasst werden, spezieller als Enon.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Flavon (chemische Verbindung) | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C15H10O2 | |||||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 222,24 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Geschichte
Die Synthese der Verbindung wurde im Jahr 1898 von Feuerstein und Kostanecki mitgeteilt.[3] Erst später wurde es als Inhaltsstoff einer Pflanze entdeckt (s. u.). Kostaneckis Ziel war die Synthese der „Muttersubstanz“ der Flavone.
Vorkommen
Zuerst wurde in den Blüten der „Fliederprimel“ (Primula malacoides) u. a. Flavon gefunden.[4] Dann wurde es in weiteren Primula-Spezies aufgefunden.[5] Auch in Mandarinen soll Flavon enthalten sein.
Herstellung
Kostanecki spekulierte, dass die Verbindung durch Hydrolyse in ein 1,3-Diketon – 1-(2-Hydroxyphenyl)-3-phenylpropan-1,3-dion – übergehen würde. Für dessen Synthese boten sich mehrere Wege an.[2] Er überlegte sich damit ein Vorgehen, das im 20. Jahrhundert als Retrosynthese bezeichnet werden sollte.
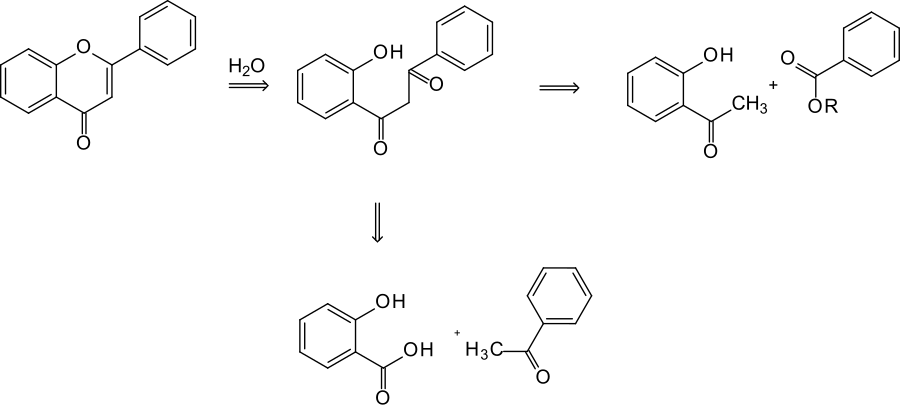
Synthese
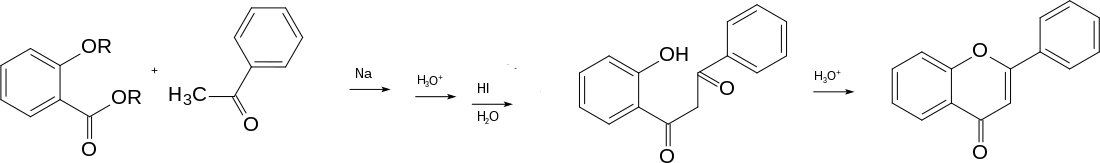
Nach der Retrosynthese naheliegend ist der Aufbau aus o-Hydroxyacetophenon (gesprochen: ortho-Hydroxyacetophenon) und Benzoesäureester. Als zweites kommen die Bausteine Salicylsäure und Acetophenon infrage. Für den Aufbau des Diketons aus ortho-Hydroxyacetophenon und Benzoesäureester stand damals als Methode die durch Natriummetall bewirkte Ester-Kondensation zur Verfügung. Es war ratsam, die saure phenolische OH-Gruppe zu schützen. Daher wurde ortho-Ethoxyacetophenon als Baustein verwendet. Ein Gemisch dieses Ketons mit Benzoesäureethylester wurde mit fein verteiltem Natriummetall umgesetzt. Das 1,3-Diketon wurde nicht isoliert – es liegt als Natriumenolat vor –, sondern mit konzentrierter Iodwasserstoffsäure erhitzt, was die „Spaltung“ des Ethylethers und den Ringschluss zum Flavon bewirkte.[2]
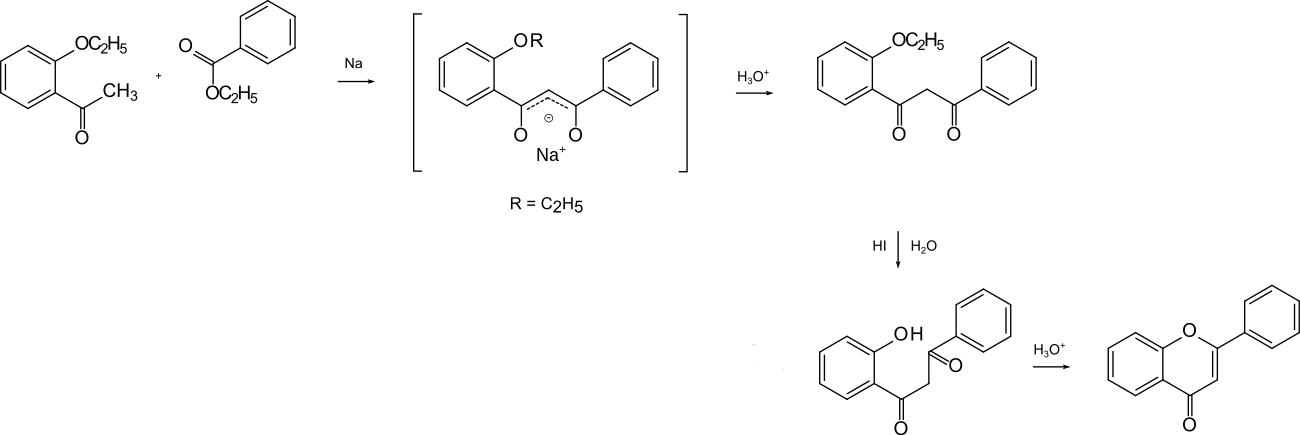
Für die Etherspaltung war Iodwasserstoffsäure nötig gewesen. Vereinfacht wurde die Synthese, indem die Benzoyl-Schutzgruppe verwendet wurde. Das ortho-Benzoyloxyacetophenon konnte mit Benzoesäureester kondensiert werden, womit (nach Ansäuern) 1-(2-Hydroxyphenyl)-3-phenylpropan-1,3-dion – das 1,3-Diketon – erhalten wurde. Diese Synthese galt lange Zeit als Standard für die Herstellung.[6]
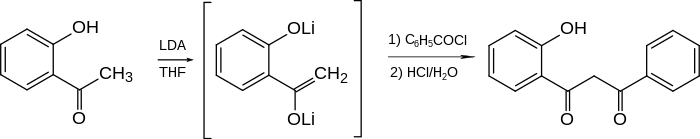
Eine direkte Synthese aus ortho-Hydroxyacetophenon – ohne Schutzgruppen – wurde erst im Jahr 1980 mitgeteilt. Nachdem Lithiumdiisopropylamid (LDA) zur Verfügung stand, wurde dieses mit Hydroxyacetophenon umgesetzt. Das gebildete Di-Lithium-Derivat wurde mit Benzoylchlorid acyliert. Hydrolyse mit Salzsäure ergab das ortho-Hydroxy-1,3-diketon. Für die Cyclisierung zum Flavon genügte 1-prozentige Schwefelsäure.[7]
Nach Kostaneckis zweitem Konzept ließ sich aus Salicylsäureethylester, dessen OH-Gruppe ebenfalls geschützt wurde (OC2H5), und Acetophenon durch Einwirkung von Natrium ebenfalls Flavon herstellen.[2]
Schließlich konnte die Phenylpropan-Kette direkt mit dem Benzo-Ring verknüpft werden. In einer Eintopfreaktion wurde Phenol mit dem Natriumenolat des Benzoylessigesters und Phosphorpentoxid umgesetzt.[8] Über den Reaktionsmechanismus dieser Synthese aus der Frühzeit der Organischen Chemie kann nur spekuliert werden.
Eigenschaften
Flavon kristallisiert in farblosen Nadeln, die federbuschartig gruppiert sind. Die Kristalle sind in Wasser schwer löslich.
Das UV-VIS-Spektrum von Lösungen des Flavons zeigt zwei Absorptionsbanden im Bereich von 286 bis 295 nm (Bande I) und 250 nm (Bande II). Im unpolaren Lösungsmittel Cyclohexan liegen die Absorptionsmaxima bei 286 und 250 nm. In polaren Lösungsmitteln ist Bande I zu längerer Wellenlänge, d. h. bathochrom verschoben, am stärksten in Methanol. Bande II ist praktisch unverändert.[9]
Biologische Bedeutung
Flavon verhindert das Wachstum von Bakterien[10] und Pilzen.[11] Auch das Zellwachstum von Tumoren der Lunge und des Darms (kolorektales Karzinom) wird durch Flavon gehemmt. Es induziert den programmierten Zelltod, die Apoptose. So könnte Flavon als Cytostatikum in der Therapie spezieller Tumoren nützlich sein.[12][13]
Siehe auch
Einzelnachweise
- Datenblatt Flavon (chemische Verbindung) bei Sigma-Aldrich, abgerufen am 14. Februar 2022 (PDF).
- St. v. Kostanecki, J. Tambor: Ueber den Aufbau der Flavons aus seinen Spaltungsproducten. In: Berichte der deutschen chemischen Gesellschaft, Jg. 1900, Bd. 33, S. 330–334; doi:10.1002/cber.19000330147.
- W. Feuerstein, St. von Kostanecki: Synthese des Flavons. In: Berichte der deutschen chemischen Gesellschaft, Jg. 1898, Bd. 31, Heft 2, S. 1757–1762; doi:10.1002/cber.18980310279.
- L. E. Weller, C. T. Redemann, R. Y. Gottshall, J. M. Roberts, E. H. Lucas, H. M. Sell: Antibacterial substances in seed plants active against tubercle bacilli. II. The antibacterial principles of Primula malacoides and Buxus sempervirens. In: Antibiotics and Chemotherapy (Northfield), Jg. 1953, Heft 6, S. 603–606; PMID 24542685.
- E. Von Wollenweber: Die Verbreitung spezifischer Flavone in der Gattung Primula. In: Biochemie und Physiologie der Pflanzen, Jg. 1974, Bd. 166, Heft 5–6, S. 419–424; doi:10.1016/S0015-3796(17)30077-X.
- T. S. Wheeler: Flavone. In: Organic Syntheses, Collective Volume, Jg. 1963, Bd. IV, S. 478; doi:10.1002/0471264180.os032.31.
- Asoke Banerji, Naresh C. Goomer: A New Synthesis of Flavones. In: Synthesis, Jg. 1980, S. 874–875; doi:10.1055/s-1980-29245.
- H. Simonis, P. Remmert: Eine neue Flavon‐Synthese. In: Berichte der deutschen chemischen Gesellschaft, Jg. 1914, S. 2229–2233; doi:10.1002/cber.191404702131.
- M. I. Sancho, M. C. Almandoz, S. E. Blanco, E. A. Castro: Spectroscopic Study of Solvent Effects on the Electronic Absorption Spectra of Flavone and 7-Hydroxyflavone in Neat and Binary Solvent Mixtures. In: International Journal of Molecular Science, Jg. 2011, Bd. 12, S. 8895–8912. doi:10.3390/ijms12128895.
- E. Schraufstätter: Die bakteriostatische Wirkung von Chalkon, Flavanon, Flavon und Flavonol. In: Experientia, Jg. 1948, Bd. 4, S. 484–486; doi:10.1007/BF02164511.
- M. Weidenbörner, H. Chandra Jha: Antifungal spectrum of flavone and flavanone tested against 34 different fungi. In: Mycological Research, Jg. 1997, Bd. 101, Heft 6, S. 733–736; doi:10.1017/S0953756296003322
- L. M. Erhart, B. Lankat-Buttgereit, H. Schmidt, U. Wenzel, H. Daniel, R. Göke: Flavone initiates a hierarchical activation of the caspase-cascade in colon cancer cells. In: Apoptosis Jg. 2005, Bd. 10, S. 611–617.
- Lisa M. Erhart: Untersuchungen zu den Wirkungen von Flavon auf humane Kolonkarzinomzellen. Dissertation Universität Marburg, 2013. PDF: d-nb.info, abgerufen am 15. Februar 2022.