Europäische Wanderheuschrecke
Die Europäische Wanderheuschrecke (Locusta migratoria) ist eine Heuschrecke aus der Familie der Feldheuschrecken (Acrididae). Sie ist, wie die anderen Wanderheuschrecken, vom Altertum bis heute ein gefürchteter landwirtschaftlicher Schädling, der in Afrika, Vorder- und Ostasien Schäden in Millionenhöhe verursacht. Die Art kommt im mediterranen Südeuropa vor, ist aber hier heute ökonomisch bedeutungslos. Von seltenen einfliegenden Einzeltieren abgesehen kommt die Art heute nicht mehr in Mitteleuropa vor; ihr früheres, dauerhaftes Vorkommen (abseits einfliegender Schwärme) ist umstritten.
| Europäische Wanderheuschrecke | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Europäische Wanderheuschrecke (Locusta migratoria), grüne Form | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name der Gattung | ||||||||||||
| Locusta | ||||||||||||
| Linnaeus, 1758 | ||||||||||||
| Wissenschaftlicher Name der Art | ||||||||||||
| Locusta migratoria | ||||||||||||
| (Linnaeus, 1758) |
Merkmale

Es handelt sich um eine große Feldheuschrecke, Männchen erreichen etwa 33 bis 51 Millimeter, die etwas größeren Weibchen 39 bis 55 Millimeter Körperlänge. Die Vorderflügel (Tegmina) sind sehr lang, sie überragen weit die Spitze des Hinterleibs, sie sind grob doppelt so lang wie die Hinterschenkel, beim Männchen maximal etwa 56, beim Weibchen 61 Millimeter lang. Der Kopf besitzt eine im Profil etwa rechteckige Gestalt, die Frons ist also vertikal. Die Stirngrübchen sind undeutlich, etwa dreieckig und grenzen direkt an die Augen an. Die Mandibeln sind bläulich gefärbt. Das Pronotum besitzt einen deutlichen Mittelkiel, der in der Mitte durch eine Querfurche eingekerbt ist, Seitenkiele fehlen. In Aufsicht ist sein Hinterrand dreieckig nach hinten vorgezogen. Der Thorax ist auf der Bauchseite von einer feinen Behaarung bedeckt. Auf der Oberseite der Hinterschenkel (Femora) sitzt oben eine Reihe kleiner spitzer Dörnchen. Die langen Sprungbeine dienen nicht nur der Fortbewegung, sondern auch der Abwehr von Artgenossen, die während der Nahrungsaufnahme zu nahe kommen. Mit rückwärts gerichteten Tritten werden sie auf Abstand gehalten. Dabei kommen auch die Dornen zum Einsatz. Die Hinterflügel sind klar (hyalin) ohne Färbung oder Bänderung.
Die Art tritt in zwei Phasen auf, einer solitären Phase, die im Habitat verbleibt und einzeln lebt, und einer gregären Phase, die sich zu großen, wandernden Schwärmen zusammenschließt. Diese sind meist an der Färbung, sonst an einigen morphologischen Merkmalen unterscheidbar. Es gibt allerdings Übergangsformen zwischen den Phasen (sog. transiens-Phase), die nicht eindeutig zuzuordnen sind. Die Individuen der solitären Phase sind meist überwiegend grün gefärbt mit dunkler Fleckenzeichnung, es kommen aber auch braune Individuen vor. Die Hinterschienen sind meist rot oder rötlich. Das Pronotum ist bei Ansicht von der Seite kaum eingeschnürt, sein Mittelkiel ist hoch, in Seitenansicht bogenförmig, der Hinterrand ist rechtwinklig. Die Individuen der gregären Phase sind braun oder braungrau gefärbt, oft mit zwei schwarzen Längsstreifen auf dem Pronotum. Die Hinterschienen sind eher gelblich. Das Pronotum ist bei Ansicht von der Seite deutlich eingeschnürt, der Mittelkiel niedrig und gerade oder sogar etwas eingesenkt, der Hinterrand ist stumpfwinklig. Die Hinterflügel sind gegenüber der solitären Phase etwas länger.[1][2]
Von der (nahe verwandten) Gattung Oedaleus ist die Europäische Wanderheuschrecke an der fehlenden Kreuzzeichnung auf dem Pronotum unterscheidbar (die dieser den Namen „Kreuzschrecken“ eingebracht hat), außerdem besitzt diese eine kontrastreiche Querbänderung der Vorderflügel. Von der Wüstenheuschrecke Schistocerca gregaria ist sie sicher an dem fehlenden zapfenförmigen Vorsprung zwischen den Vorderhüften unterscheidbar. Die in Südeuropa recht häufige Anacridium aegypticum ist leicht anhand von deren gestreiften Komplexaugen unterscheidbar.
Lebenszyklus
In den nördlicheren Teilen ihres Verbreitungsgebiets erreicht die Art eine Generation pro Jahr; in den Tropen können sich aber bis zu fünf Generationen im Jahr entwickeln, sie entwickelt sich hier ohne obligate Diapause; Imagines treten dann ganzjährig auf. Bereits in Nordafrika werden drei Generationen im Jahr erreicht[3]. In winterkalten Klimaten überwintert die Art im Eistadium. Die Eier werden in von einer schaumartigen Substanz umhüllten Ootheken in den Boden abgelegt, jede Oothek enthält 50 bis 70 Eier.[4] Zur erfolgreichen Entwicklung müssen sie Wasser aus dem umgebenden Boden aufnehmen, dies dauert etwa 10 bis 20 Tage. Die Erstlarven schlüpfen in den nördlichen Teilen des Verbreitungsgebiets etwa Mitte bis Ende Mai, in Nordafrika (Algerien) bereits im März.[3] Die Art besitzt fünf Larvenstadien, die unter günstigen Bedingungen jeweils in fünf bis sechs Tagen durchlaufen werden, insgesamt ergeben sich so 35 bis 40 Tage Entwicklungszeit.[2] Die Nymphen (im englischen Sprachraum hopper genannt) der gregären Phase schließen sich sofort nach dem Schlupf zu großen Schwärmen zusammen.

Stridulation und Hörvermögen
Im Gegensatz zu zahlreichen anderen Feldheuschrecken-Arten locken Männchen der Europäischen Wanderheuschrecke die Weibchen nicht mittels Stridulation an. Die Männchen können auf die bei Feldheuschrecken übliche Weise (Reibung der Hinterbeine über die Deckflügel) Töne erzeugen, setzen diese aber nur ein, wenn sie bei der Paarung durch Konkurrenten gestört werden[5]. Beide Geschlechter besitzen funktionsfähige Tympanalorgane und Hörvermögen, das sie zur Feindvermeidung einsetzen, sie sind zum Beispiel imstande, die Ultraschall-Ortungslaute fliegender Fledermäuse zu hören und diesen auszuweichen.[6][7] Das Hörvermögen der Art und seine neuronale Basis wurde umfangreich getestet, sie dient als Modellorganismus zur Physiologie des Hörens bei Insekten.
Lebensraum
Es handelt sich um eine recht euryöke Art, wie sich schon aus dem riesigen, mehrere Kontinente umspannenden Verbreitungsgebiet ergibt. Die Art ist aber in Ei- und Larvalphase feuchtebedürftig und kommt nur in bodenfeuchten Lebensräumen vor. Vorzugshabitate sind offene, unbewaldete, oft sandige Auen und Uferzonen von Gewässern, insbesondere die breiten, nur zeitweise wasserführenden Talungen von unregulierten Wildflusslandschaften und Flussdeltas bieten optimale Bedingungen. In den feuchten Tropen kommt sie auch in sekundären Grasländern (nach Waldrodung) zur Entwicklung. Sie geht auch in gewissem Ausmaß auf entsprechendes Kulturland über, so wurde sie in der algerischen Sahara erst mit Bewässerungskulturen ansässig;[8] in der Regel verschwindet sie aber bei intensiverer Landbewirtschaftung. Die Art ist, besonders im Eistadium, recht frosttolerant, Imagines sind aber bei Exposition von Temperaturen unter dem Gefrierpunkt nicht lange lebensfähig. Die Nordgrenze der Verbreitung in Asien korreliert etwa mit der südlichen Grenze der Taiga-Zone, wobei nördlich und südlich verbreitete Populationen stark unterschiedliche Kältetoleranz zeigen.[9]
Die Art ernährt sich bevorzugt von Gräsern,[10] nimmt aber bei Nahrungsmangel eine Vielzahl anderer Pflanzen an. Sie fressen dann an anderen Monokotyledonen, an zweikeimblättrigen Pflanzen nur als Notnahrung, wenn nichts anderes zur Verfügung steht. Eine verbreitete Nahrungspflanze der solitären Form ist insbesondere Schilfrohr (Phragmites australis).
Morphen
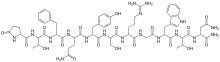
Die solitäre (einzellebende) und gregäre (schwarmbildende) Form der Europäischen Wanderheuschrecke unterscheiden sich nicht nur als Imagines und Nymphen in Körpergestalt und Färbung, sondern auch in Physiologie und Verhaltensmerkmalen. Die solitäre Form lebt länger und produziert mehr Eier, sie ist überwiegend nachtaktiv. Die gregäre Form bildet große Schwärme, die auch tagsüber fliegen. Obwohl etwas kleiner und leichter als die solitäre Form, ist ihr Gehirn größer.
Die gregäre Form wird durch Umweltreize im Nymphenstadium induziert. Leben zahlreiche Nymphen auf engem Raum beieinander, weil viele Weibchen hier nebeneinander zahlreiche Eier abgelegt hatten, ist es unvermeidlich, dass sie ständig aneinanderstoßen. Berührungsrezeptoren auf der Körperoberfläche, insbesondere in den Antennen und den großen Femora der Sprungbeine, bewirken den Übergang zur Wanderform, wenn sie häufig gereizt werden. Dazu sind unter Laborbedingungen bereits zwei Stunden Gedränge ausreichend. Im Freiland erfolgt der Übergang allerdings meist graduell, über einige Generationen verteilt.
Die Auslösung der gregären Form ist ein Dimorphismus, der durch epigenetische Mechanismen gesteuert und ausgelöst wird (Unterschiede im Erbgut existieren nicht). Die Forschung zur Auslösung konzentrierte sich jahrzehntelang auf hormonelle Faktoren. Unterschiede bestehen etwa im Spiegel des Juvenilhormons und im Serotonin-Spiegel; das an der Stressreaktion beteiligte Corazonin, ein Neuropeptid, wurde als wesentlich verantwortlich für den Färbungswechsel identifiziert. Allerdings löst keine dieser Substanzen allein die vollständige Umwandlung aus. Neuere Forschungen konzentrieren sich nun auf einen möglichen Weg über genomische Prägung durch (unter Umständen epigenetisch vererbbare) DNA-Methylierung. Die Details des Phasenwechsels sind aber bis heute nicht aufgeklärt.[11]
Bereits die Nymphenschwärme der Wanderform können ungeheure Dichten erreichen. Teilweise wurde berichtet, dass der Grund 15 Zentimeter tief von Heuschreckenlarven bedeckt war. Die älteren Stadien bilden Marschkolonnen aus, die über längere Zeit ihre Richtung beibehalten, dabei wurden vom Schwarm Entfernungen von 24 Kilometer zurückgelegt. Imaginale Heuschrecken der Wanderform fliegen tagsüber (mit dem Wind), meist legen sie in den Mittagsstunden eine Rast ein, sie fressen überwiegend in der Abenddämmerung. Wenn vorhanden, bevorzugen sie als Nahrung Gräser, darunter auch die zu den Gräsern gehörenden Getreide-Arten. Fliegende Schwärme legen Hunderte von Kilometern zurück. Oft bilden sich in den Einfluggebieten durch abgelegte Eier sekundäre Schwärme. Abkömmlinge eines aus einem primären Ausbruchsgebiet in Mali im Jahr 1929 stammenden Schwarms erreichten 1932 Südafrika, eine Wanderstrecke von etwa 7.000 Kilometer.[12]
Verbreitung
Die Europäische Wanderheuschrecke besiedelt ganz Afrika einschließlich der Insel Madagaskar, Süd- und Südosteuropa und fast ganz Asien südlich der borealen Nadelwaldzone. Im Osten erreicht sie die Insel Kunashir (Kurilen).[2] Sie kommt über die südostasiatischen Inselketten bis nach Australien und Neuseeland vor.[12]
In Europa tritt die Art in allen Ländern am Mittelmeer auf. Die Nordgrenze der Verbreitung liegt an den Südalpen, sie erreicht im Kanton Tessin die Schweiz. Früher bestehende Populationen am Vorderrhein und im Rhonetal (Wallis) sind mit der Flussregulation und der damit verbundenen Zerstörung der Auenlandschaft heute erloschen.[13] In Mittel- und Nordeuropa wird die Art seit ca. 1950 kaum noch beobachtet, obwohl gelegentlich Einzeltiere gemeldet werden.[14]
In Deutschland wurden einfliegende Schwärme in den Chroniken seit dem Mittelalter vermeldet; die Art hat bei den Chronisten schon deshalb besondere Aufmerksamkeit gefunden, weil sie zu den biblischen Plagen gehörte. In den Xantener Annalen aus dem 9. Jahrhundert n. Chr. heißt es beispielsweise: „Im Jahr der göttlichen Menschwerdung 873 verwüstete eine unermessliche Menge von Heuschrecken, die im Monat August von Osten her erschien, fast ganz Gallien. Sie waren größer als andere Heuschrecken und hatten sechs Flügelpaare.“[15] Zumindest die Anzahl der Flügelpaare ist definitiv als falsche Beobachtung anzusehen. Die beobachteten Schwärme zogen vor allem entlang der Flusstäler von Donau, Elbe und Oder, als Herkunftsgebiet wird das Donaudelta und die Steppenregion zwischen der Donau- und der Dnepr-Mündung am Schwarzen Meer vermutet.[16] Der letzte Fund eines Einzeltiers auf deutschem Boden stammt aus dem Jahr 1949. Ob sich die Art jemals in Deutschland reproduzieren konnte, ist dabei nicht mehr nachvollziehbar. Ebenfalls liegen keine Erkenntnisse über Populationen in Baden-Württemberg vor, das an bekannte Populationen in Frankreich und der Schweiz grenzt.[17] Letzte Funde von dort stammen aus dem Oberrheintal bei Freiburg im Breisgau 1846[18] sowie mehrfache Funde im Landkreis Karlsruhe 1847 und dem Mittleren Neckarraum (Stuttgart-Hohenheim) 1859.[17]
Taxonomie
Die Art wurde von Carl von Linné 1758 als Gryllus (Locusta) migratorius erstbeschrieben.[19] Diese Beschreibung bezog sich auf die gregäre Form, Linné hatte auch die solitäre Form, unter dem Namen Gryllus (Locusta) danica ein zweites Mal beschrieben. Die Art wurde durch nachträgliche Entscheidung der ICZN 1944 zur Typusart der Gattung Locusta erklärt, um der traditionellen Verwendung Rechnung zu tragen. Die Art- und Gattungsauffassung war über Jahrhunderte verworren. Zeitweise wurden elf Unterarten anerkannt, von denen die meisten von verschiedenen Bearbeitern irgendwann auch in den Artrang erhoben wurden. Es existieren deshalb zahlreiche Synonyme (zur Synonymie vgl.[20]).
In einer Studie von 2012 wurde dann die genetische Struktur der Art erstmals umfassend aufgeklärt.[21] In Übereinstimmung mit zahlreichen vorhergehenden Studien konnten dabei die meisten der traditionellen Subspezies nicht differenziert werden. Es ergab sich eine zweigeteilte genetische Struktur aus einer nördlichen und einer südlichen Linie. Die südliche umfasst Populationen aus Afrika (einschließlich Madagaskar), dem mediterranen europäischen Raum, Kleinasien, dem tropischen Südasien einschließlich Südchina und Australien. Die nördliche Linie umfasst Tiere aus Frankreich, Russland, Zentralasien, Nordostchina und Japan. Damit wurde für Frankreich das, morphologisch bereits lange erkannte, Vorkommen mehrerer Taxa nebeneinander[22] bestätigt. Anhand älterer Namen wurde die nördliche Linie als Typusunterart Locusta migratoria migratoria, die südliche als Unterart Locusta migratoria migratorioides gefasst. Obwohl eine genetische Binnenstruktur auch dieser Linien erkennbar ist, wobei die Tiere von Madagaskar genetisch am weitesten differierten, sind diese untereinander zu ähnlich, um weitere Subtaxa begründen zu können. In Eurasien sind die nördliche und südliche Unterart meist durch den paläarktischen Wüstengürtel voneinander getrennt, sie kommen aber am westlichen (Frankreich) und am östlichen (China) Ende auch unmittelbar in Kontakt zueinander. Trotz des riesigen bewohnten Areals verhindert wohl die Schwarmbildung ansonsten eine genetische Differenzierung innerhalb der Art. Die genetische Populationsstruktur (Phylogeografie) lässt einen Ursprung der Art in Afrika wahrscheinlich erscheinen, wo zahlreiche recht nahe verwandte und ähnliche Arten leben.
Europäische Wanderheuschrecke und der Mensch
Bedeutung als Schädling und Bekämpfung

Wie alle Wanderheuschrecken-Arten kann Locusta migratoria insbesondere bei Massenauftreten in der Wanderform sehr hohe Schäden in der Landwirtschaft verursachen. Schadensberichte liegen in großer Zahl vor. Die historischen Berichte über „Heuschreckenschwärme“ in Mitteleuropa werden gewöhnlich auf diese Art bezogen, auch wenn die Artzugehörigkeit nach den Angaben der Chronisten meist nicht wirklich erkennbar ist. Der Entomologe Herbert Weidner hat den Einflug eines Schwarms im Jahr 1693 anhand von historischen Quellen rekonstruiert. Die Tiere stammten offensichtlich aus der Schwarzmeerregion und wanderten die Donau aufwärts, wobei es in den Steppenregionen am mittleren Donautal sekundäre Ausbreitungszentren gegeben haben muss. Von hier erfolgte eine Masseneinwanderung in die Gegend von Wien: Teilschwärme drangen ins Inntal, nach Böhmen und Schlesien, nördlich bis Thüringen vor, Einzeltiere erreichten sogar England.[23] Generell ist festzuhalten, dass die Larvalstadien (Nymphen) um einiges gefräßiger sind als die Adulti, die sich überwiegend um die Reproduktion bemühen.
Aktuellere Schadensberichte gibt es z. B. seit 2003 aus Nordchina.[24] Dort waren zeitweise mehr als 20.000 Hektar Grasland betroffen, die Nymphen erreichten Dichten bis 1.000 Individuen pro Quadratmeter. Weitere Schäden werden zum Beispiel aus Nordost-Indien und insbesondere aus Afrika gemeldet. In Zentralasien hat die Bedeutung der Art gegenüber trockenheitsliebenderen Arten wie Calliptamus italicus aufgrund des Absterbens der Feuchtgebiete am Aralsee abgenommen.[25] In Australien ist die ökonomische Bedeutung der Art im Vergleich zu anderen Wanderheuschrecken gering.[26]
Die verbreitetste Methode der Bekämpfung ist Sprühen von Insektiziden, vor allem der Wirkstoffklasse der Phosphorsäureester, wie zum Beispiel Malathion. Nach jahrzehntelangem Einsatz der Mittel haben allerdings, wie zu erwarten, einige Lokalpopulationen Resistenzen gegen diese entwickelt.[27] Auch das aus dem Niembaum gewonnene Azadirachtin, eine Substanz mit hormoneller Wirkung, wird gegen die Heuschrecken eingesetzt. In Australien gibt es zudem Feldversuche mit dem insektenpathogenen Pilz Metarhizium anisopliae.[28]
Bedeutung als Lebensmittel

Die Europäische Wanderheuschrecke wird in Europa als Speiseinsekt genutzt. In der Schweiz ist sie seit dem 1. Mai 2017 als Lebensmittel zugelassen. Europäische Heuschrecken dürfen damit unter bestimmten Voraussetzungen als ganze Tiere, zerkleinert oder gemahlen an Verbraucher abgegeben werden.[29] In der EU gelten Speiseinsekten als neuartige Lebensmittel und bedürfen einer Zulassung, der eine Sicherheitsprüfung vorausgeht. Im Jahr 2018 wurden zwei Zulassungsanträge für die Europäische Wanderheuschrecke eingereicht.[30][31] Am 2. Juli 2021 veröffentlichte die Europäische Behörde für Lebensmittelsicherheit eine wissenschaftliche Stellungnahme, in der sie für gefrorene, getrocknete oder gemahlene Wanderheuschrecken keine Sicherheitsbedenken für die Allgemeinbevölkerung feststellte.[32] Am 12. November 2021 bestätigen die Mitgliedstaaten gegenüber der EU-Kommission eine Zulassung der Europäischen Wanderheuschrecke als Lebensmittel.[33][34][35] Die Zulassung erfolgte rechtlich mit der Durchführungsverordnung 2021/1975 der Kommission vom 12. November 2021.[36] Damit ist die Europäische Wanderheuschrecke – nach dem Mehlwurm – das zweite, in der EU zugelassene Speiseinsekt.
Bedeutung als Futtermittel
L. migratoria wird als Futtertier in verschiedenen Larvenstadien im Zoohandel für Terrarientiere (Reptilien und Amphibien) gezüchtet und verkauft.
Haltung
Wichtig bei der Aufzucht beziehungsweise Haltung von L. migratoria ist Wärme, gelegentliche UV-Bestrahlung und ausreichend Grünfutter. Sollte dieses nicht in ausreichenden Mengen vorhanden sein, empfiehlt es sich, schnellwachsenden Weizen zu ziehen. Gerne wird auch ein Stückchen Banane verzehrt. Für die Eiablage wird im Terrarium ein ca. 15 Zentimeter hoher Erdbereich (möglichst Sand) benötigt. Die Entwicklung vom Ei bis zur Larve dauert je nach Umgebungstemperatur ca. einen Monat.
Literatur
Peter Detzel: Locusta migratoria (Linnaeus 1758) In: Die Heuschrecken Baden-Württembergs. Eugen Ulmer Verlag, 1998. S. 366-369. ISBN 3-8001-3507-8.
Weblinks
Einzelnachweise
- Kurt Harz: Geradflügler oder Orthoptera. In: Friedrich Dahl (Begründer): Die Tierwelt Deutschlands und der angrenzenden Meeresteile. 44. Teil. Gustav Fischer Verlag, Jena, 1960.
- I. Ya. Grichanov: Locusta migratoria L. - Migratory Locust, Asiatic Locust. Interactive Agricultural Ecological Atlas of Russia and Neighboring Countries. Economic Plants and their Diseases, Weeds and Pests. 2003-2009 online
- Leila Benfekih, Daniel Petit (2010): The annual cycle of Saharan populations of Locusta migratoria cinerascens (Orthoptera: Acrididae: Oedipodinae) in Algeria. Annales de la Société Entomologique de France (n.s.) 46 (3–4): 351-358.
- George Basil Popov, My Hanh Launois-Luong, Jaap van der Weel (1990): Les Ootheques des Criquets du Sahel. Collection Acridologie Opérationnelle no.7. Comité Permanent Inter-États de Lutte contre la Sécheresse dans le Sahel. [locust.cirad.fr/ouvrages_pratiques/pdf/DFPV7.pdf PDF]. Abb. auf Seit 70.
- A. R. Bar-Ilan, A. Shulov, M. P. Pener (1969): The Stridulation of Sexually Mature Males of Locusta migratoria migratorioides (R. and F.) in Relation to Temperature and Some Other Factors. Physiological Zoology Vol. 42, No. 4: 417-428.
- Daniel Robert (1989): The auditory behaviour of flying locusts. Journal of experimental Biology 147: 279-301.
- J. W. Dawson, W. Kutsch, R. M. Robertson (2004): Auditory-evoked evasive manoeuvres in free-flying locusts and moths. Journal of Comparative Physiology A 190: 69–84. doi:10.1007/s00359-003-0474-3
- Leila Benfekih, Antoine Foucart, Daniel Petit (2011): Central Saharan populations of Locusta migratoria cinerascens (Orthoptera: Acrididae) in irrigated perimeters: is it a recent colonisation event? Annales de la Société Entomologique de France (n.s.) 47 (1–2): 147-153.
- Xiao-Hong Jing & Le Kang (2003): Geographical variation in egg cold hardiness: a study on the adaptation strategies of the migratory locust Locusta migratoria L. Ecological Entomology 28: 151–158.
- E.A. Bernays, R.F. Chapman, J.MacDonald J.E.R. Salter (1976): The degree of oligophagy in Locusta migratoria (L.). Ecological Entomology 1: 223–230. doi:10.1111/j.1365-2311.1976.tb01227.x
- Abschnitt nach Bart Boerjan, Filip Sas, Ulrich R. Ernst, Julie Tobback, Filip Lemière, Michiel Vandegehuchte, Collin R. Janssen, Liesbeth Badisco, Elisabeth Marchal, Heleen Verlinden, Liliane Schoofs, Arnold De Loof (2011): Locust phase polyphenism: Does epigenetic precede endocrine regulation? General and Comparative Endocrinology 173(1): 120-128. doi:10.1016/j.ygcen.2011.05.003
- Verbreitungskarte in: A. Steedman (Editor) (1990): Locust handbook. (3rd edition) Chatham: Natural Resources Institute, vi + 204pp. digitalisiert: The New Zealand Digital Library
- Afrikanische Wanderheuschrecke Locusta cinerascens bei Orthoptera.ch
- T. Usaitis T., L. Bumbulyte (2011): New record of Locusta migratoria (Linnaeus, 1758) (Orthoptera: Acrididae) from Lithuania. New and Rare for Lithuania Insect Species 23: 112–113.
- Zitat nach Jana Sprenger: „Die Landplage des Raupenfraßes“ Wahrnehmung, Schaden und Bekämpfung von Insekten in der Forst- und Agrarwirtschaft des preußischen Brandenburgs (1700-1850). Diss. Georg-August-Universität Göttingen, 2011. ISBN 978-3-930037-76-6
- Z.V. Waloff (1940): The Distribution and Migrations of Locusta in Europe. Bulletin of Entomological Research, Volume 31, Issue 3: 211-246.
- Peter Detzel: Die Heuschrecken Baden-Württembergs. Eugen Ulmer Verlag, 1998. ISBN 3-8001-3507-8.
- L. H. Fischer (1848): Über einige Orthopteren Freiburgs. Entomologische Zeitschrift Stettin 9, S. 23-51.
- C. Linnæus (1758): Systema naturæ per regna tria naturæ, secundum classes, ordines, genera, species, cum characteribus, differentiis, synonymis, locis. Tomus I. Editio decima, reformata. - pp. [1-4], 1-824. Holmiæ. (Salvius). digitalisiert durch GDZ Göttinger Digitalisierungszentrum
- Locusta migratoria in Orthoptera Species File online (Version 5.0/5.0)
- Chuan Ma, Pengcheng Yang, Feng Jiang, Marie-Pierre Chapuis, Yasen Shali, Gregory A Sword, Le Kang (2012): Mitochondrial genomes reveal the global phylogeography and dispersal routes of the migratory locust. Molecular Ecology 21: 4344–4358 doi:10.1111/j.1365-294X.2012.05684.x
- Bernard Defaut (2006): Eléments pour la Faune de France des Caelifères: 5. A propos de Locusta migratoria cinerascens (Fabricius, 1781) (Caelifera, Acrididae, Oedipodinae). Matériaux Orthoptériques et Entomocénotiques, 11: 59-61.
- Herbert Weidner (1986): Die Wanderwege der Europäischen Wanderheuschrecke, Locusta migratoria migratoria Linnaeus, 1758 in Europa im Jahre 1693 (Saltatoria, Acridiidae, Oedipodinae). Anzeiger für Schädlingskunde, Pflanzenschutz, Umweltschutz 59: 41-51.
- Seiji Tanaka & Dao-Hong Zhu (2005): Outbreaks of the migratory locust Locusta migratoria (Orthoptera: Acrididae) and control in China. Applied Entomology and Zoology Vol. 40 No. 2: 257-263. free download
- F. A. Gapparov & A. V. Latchininsky (2000): What are the Consequences of Ecosystem Disruption on Acridid Diversity and Abundance? In: Jeffrey A. Lockwood, Alexandre V. Latchininsky, Michael G. Sergeev (editors): Grasshoppers and Grassland Health. Managing Grasshopper Outbreaks without Risking Environmental Disaster. NATO Science Series 2. Environmental Security.
- History of locust and grasshopper outbreaks in Australia (Memento des Originals vom 10. Dezember 2008 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.. Australian Government, Department of Agriculture. last reviewed 8. Juni 2012.
- Galina Benkovskaya, Konstantin Kitaev, Elena Surina, Maxim Udalov (2011): Research Progress in Understanding Insecticide Resistance in Oriental Migratory Locust, Locusta migratoria manilensis. Resistant Pest Management Newsletter Vol. 20, No. 2: 257-263.
- J.C. Scanlan, W.E. Grant, D.M. Hunter, R.J. Milner (2001): Habitat and environmental factors influencing the control of migratory locusts (Locusta migratoria) with an entomopathogenic fungus (Metarhizium anisopliae). Ecological Modelling, Volume 136, Issues 2–3: 223–236. doi:10.1016/S0304-3800(00)00424-5
- BLV (28. April 2017): Insekten als Lebensmittel.
- Europäische Kommission (2018): Summary of the dossier: Migratory locust (Locusta migratoria). Dossier des Zulassungsantrags für Europäische Wanderheuschrecken als Lebensmittel (Novel Food).
- Europäische Kommission (2018): Whole and ground Grasshopper (Locusta migratoria). Dossier des Zulassungsantrags für ganze und gemahlene Europäische Wanderheuschrecken als Lebensmittel (Novel Food).
- EFSA (2. Juli 2021): Safety of frozen and dried formulations from migratory locust (Locusta migratoria) as a Novel food pursuant to Regulation (EU) 2015/2283. In: EFSA Journal. Vol. 19, Issue 7. DOI: https://doi.org/10.2903/j.efsa.2021.6667.
- Europäische Kommission (12. November 2021): Approval of second insect as a Novel Food.
- Vertretung der Europäischen Kommission in Deutschland (12. November 2021): Wanderheuschrecke: Kommission lässt zweites Insekt als Lebensmittelzutat für den EU-Markt zu.
- Der Spiegel (12. November 2021): EU-Kommission gibt Wanderheuschrecke als Lebensmittel frei.
- EU-Kommission (15. November 2021): Durchführungsverordnung (EU) 2021/1975 der Kommission vom 12. November 2021 zur Genehmigung des Inverkehrbringens von gefrorener, getrockneter und pulverförmiger Locusta migratoria als neuartiges Lebensmittel gemäß der Verordnung (EU) 2015/2283 des Europäischen Parlaments und des Rates sowie zur Änderung der Durchführungsverordnung (EU) 2017/2470 der Kommission.