Ethylnitrit
Ethylnitrit, der Salpetrigsäureester des Ethanols, ist bei Raumtemperatur (20 °C) ein farbloses, hochentzündliches und giftiges Gas.[1]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
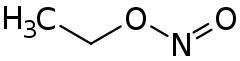 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Ethylnitrit | |||||||||||||||
| Andere Namen |
Salpetrigsäureethylester | |||||||||||||||
| Summenformel | C2H5NO2 | |||||||||||||||
| Kurzbeschreibung |
farbloses bis gelbliches Gas bzw. Flüssigkeit mit etherischem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 75,07 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||
| Dichte |
0,9062 g·cm−3 (Flüssigkeit bei 8,8 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
17 °C[1] | |||||||||||||||
| Löslichkeit |
wenig in Wasser unter Zersetzung[1] | |||||||||||||||
| Brechungsindex |
1,3418 (10 °C, 589 nm)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Darstellung
Ethylnitrit entsteht beim Einwirken von kalter, verdünnter Schwefelsäure auf eine Wasser-Ethanol-Lösung von Natriumnitrit.[4][5]
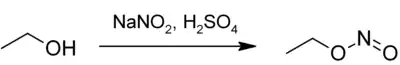
Ethylnitrit kann auch durch Umsetzung von Silbernitrit mit Iodethan hergestellt werden.[6]
Eigenschaften
Physikalische Eigenschaften
Mit einem Siedepunkt bei Normaldruck von 17 °C ist Ethylnitrit bei Normaltemperatur eine farblose bis gelbliche Flüssigkeit mit etherischem Geruch[1], bei Raumtemperatur schon ein farbloses Gas. Die Verbindung hat einen Schmelzpunkt von −50 °C.[1] Die Dampfdruckfunktion ergibt sich nach August entsprechend lg(P) = −A/T+B (P in Torr, T in K) mit A = 1340 und B = 7,50 im Temperaturbereich von 255 K bis 280 K.[7] Aus der Dampfdruckfunktion lässt sich eine molare Verdampfungsenthalpie von 27,84 kJ·mol−1 ableiten.[7]
Ethylnitrit liegt wie andere Alkylnitrite als Gemisch aus dem anti und dem syn Konformeren vor. Die Umwandlungsenthalpie zwischen beiden Konformeren beträgt 1,477 kJ·mol−1.[8]
Sicherheitstechnische Kenngrößen
Ethylnitrit bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt von −35 °C. Der Explosionsbereich liegt zwischen 3,0 Vol.‑% (90 g/m3) als untere Explosionsgrenze (UEG) und 50 Vol.‑% (1555 g/m3) als obere Explosionsgrenze (OEG).[9] Der maximale Explosionsdruck beträgt 11,6 bar.[9] Die Grenzspaltweite wurde mit 0,96 mm bestimmt.[9] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA.[9] Die Zündtemperatur beträgt 90 °C.[1] Der Stoff fällt somit in die Temperaturklasse T6.
Verwendung
Ethylnitrit ist der wichtigste Inhaltsstoff in Witdulsies, einem traditionellen auf Ethanol basierenden südafrikanischen Mittel gegen Erkältungen und Grippe, welches in Apotheken verkauft wurde. Allerdings hat die FDA das Mittel schon 1980 in den USA, vertrieben als Süßes Nitrit oder Salpetergeist, verboten.[10]
Einzelnachweise
- Eintrag zu Ethylnitrit in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Januar 2019. (JavaScript erforderlich)
- Eric G. Cowley, James R. Partington: 293. Studies in dielectric polarisation. Parts VIII, IX, X, and XI. In: Journal of the Chemical Society (Resumed). 1933, ISSN 0368-1769, S. 1252, doi:10.1039/jr9330001252.
- Eintrag zu Ethyl nitrite im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- L. F. Fieser, M. Fieser: Organischen Chemie. 2. Auflage, Verlag Chemie, 1975. - P. Tarte: Rotational Isomerism as a General Property of Alkyl Nitrites. In: The Journal of Chemical Physics. Band 20, Nr. 10, 1952, S. 1570–1575, doi:10.1063/1.1700218.
- J. Thiele und H. Eichwede, Justus Liebigs Annalen der Chemie 311 (1900), Fußnote auf Seite 366: Etwas abweichend von den gewöhnlichen Methoden stellt man dasselbe vortheilhaft dar, indem man 200 g Natriumnitrit in so viel Wasser löst, dass 150 g Alkohol keine Fällung geben und bei gewöhnlicher Temperatur verdünnte Salzsäure in das Gemisch einlaufen lässt, wobei sich das Aethylnitrit in regelmässigem Strome entwickelt. Ausbeute 80-85 pC. der Theorie.
- Donald L. Pavia, Gary M. Lampman, George S. Kriz: Organic Chemistry, Band 2. Thompson Custom Publishing, Mason, Ohio 2004, ISBN 0-03-014813-8.
- H. W. Thompson, F. S. Dainton: The photochemistry of alkyl nitrites. III. In: Transactions of the Faraday Society. Band 33, 1937, S. 1546–1555, doi:10.1039/TF9373301546.
- K. I. Lazaar, S. H. Bauer: Intramolecular conversion rates over low barriers. 2. The alkyl nitrites. In: The Journal of Physical Chemistry. Band 88, Nr. 14, 1984, S. 3052–3059, doi:10.1021/j150658a025.
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen – Band 1: Brennbare Flüssigkeiten und Gase, Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003.
- FDA: Rulemaking History for OTC Sweet Spirits of Nitre Drug Products

