Iodethan
Iodethan ist eine chemische Verbindung aus der Gruppe der aliphatischen, gesättigten Halogenkohlenwasserstoffe.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
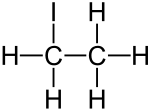 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Iodethan | |||||||||||||||
| Andere Namen |
Ethyliodid | |||||||||||||||
| Summenformel | C2H5I | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit etherischem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 155,97 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
1,94 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
71 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
schwer in Wasser (4 g·l−1 bei 20 °C)[1] | |||||||||||||||
| Brechungsindex |
1,513 (20 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−40,0 kJ/mol[3] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Gewinnung und Darstellung
Iodethan kann durch Reaktion von Ethanol mit Iod in Gegenwart von rotem Phosphor oder durch Addition von Iodwasserstoff an Ethen gewonnen werden.[4]
Eigenschaften
Iodethan ist eine farblose, leicht flüchtige, entzündbare Flüssigkeit mit etherischem Geruch, die schwer löslich in Wasser ist.[1] Sie besitzt eine dynamische Viskosität von 0,556 mPa·s bei 25 °C. Bei Kontakt mit Licht verfärbt sich Iodethan rot und zersetzt sich langsam in Wasser. Das technische Produkt enthält Silber, Ethanol oder Kupfer als Stabilisator.[2][1][4]
Verwendung
Iodethan wird als Schwerflüssigkeit für die Mineralienanalysen und für organische Synthese verwendet.[1]
Sicherheitshinweise
Die Dämpfe von Iodethan können mit Luft beim Erhitzen des Stoffes über seinen Flammpunkt explosive Gemische bilden.[1]
Einzelnachweise
- Eintrag zu Iodethan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2018. (JavaScript erforderlich)
- Datenblatt Iodoethane, 99% bei Sigma-Aldrich, abgerufen am 20. Juni 2012 (PDF).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-22.
- Karl-Heinz Lautenschläger, Werner Schröter, Andrea Wanninger: Taschenbuch der Chemie. Harri Deutsch, 2005, ISBN 978-3-8171-1760-4, S. 453 (eingeschränkte Vorschau in der Google-Buchsuche).

