Eteplirsen
Eteplirsen (Handelsname: Exondys 51; Hersteller: Sarepta Therapeutics Inc.) ist ein Medikament aus der Gruppe der Antisense-Therapeutika, das zur Behandlung der Duchenne-Muskeldystrophie (DMD) eingesetzt wird.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
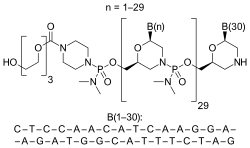 | |||||||||||||
| Allgemeines | |||||||||||||
| Freiname | Eteplirsen | ||||||||||||
| Andere Namen |
(P-deoxy-P-(dimethylamino)](2',3'-dideoxy-2',3'-imino-2',3'-seco)(2'a→5')(C-m5U-C-C-A-A-C-A-m5U-C-A-A-G-G-A-A-G-A-m5U-G-G-C-A-m5U-m5U-m5U-C-m5U-A-G),5'-(P-(4-((2-(2-(2-hydroxyethoxy)ethoxy)ethoxy)carbonyl)-1-piperazinyl)-N,N-dimethylphosphonamidate) RNA | ||||||||||||
| Summenformel | C365H569N177O122P30 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Arzneistoffangaben | |||||||||||||
| ATC-Code |
M09AX06 | ||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 10305,738 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
In den USA erhielt Exondys 51 im September 2016 eine beschleunigte Zulassung (fast track) durch die US-amerikanische Food and Drug Administration (FDA).[2] In Europa wurde die Zulassung verweigert.[3] Eine umfassende Übersicht über den Arzneistoff und seine klinischen Studien wurde Anfang 2017 in der ausschließlich online publizierenden Fachzeitschrift Drug Design, Development and Therapy veröffentlicht.[4]
Duchenne-Muskeldystrophie (DMD)
Die Muskeldystrophie vom Typ Duchenne ist die häufigste muskuläre Erbkrankheit im Kindesalter. Sie tritt etwa in einer Frequenz von 1:5000 pro männlichen Neugeborenen auf und fällt damit per definitionem in die Kategorie der seltenen Erkrankungen („Orphan Diseases“). Aufgrund der x-chromosomalen Vererbung sind fast nur Jungen betroffen. In ca. 1/3 aller Fälle wird die Erkrankung jedoch auch durch eine Spontanmuation des Dystrophin-Gens verursacht. Die Krankheit beginnt im Kleinkindalter mit einer Schwäche der Becken- und Oberschenkelmuskulatur, schreitet rasch voran und endet, meist im jungen Erwachsenenalter, immer tödlich, sobald die Herz- und Atemmuskulatur abgebaut wird.
Eine Heilung ist bisher nicht möglich. Eteplirsen ist das erste – zunächst nur in den USA[2] – zugelassene Medikament zur Behandlung der DMD. Eteplirsen zielt auf Mutationen in einer Region, die an 13 % der DMD-Fälle beteiligt sind.[5]
Anwendungsgebiete
Eteplirsen ist zugelassen zur Behandlung der Duchenne-Muskeldystrophie (DMD).[2] Das Arzneimittel wird intravenös oder subkutan verabreicht.
Wirkungsmechanismus
Die Ursache für die Entstehung der Muskeldystrophie Duchenne sind Mutationen im Gen für Dystrophin. Dabei handelt es sich häufig um Deletionen, zum Beispiel in Exon 50. Dystrophin ist für die Funktion des Muskels essenziell.
Eteplirsen ist ein Phosphorodiamidat-Morpholino-Oligomer (PMO), das selektiv an das Exon 51 der prä-mRNA bindet. Es handelt sich um ein Antisense-Oligonukleotid mit einem hohen Molekulargewicht. Die Sequenz ist komplementär zum Abschnitt in der prä-mRNA. Eteplirsen ist ein RNA-Analogon, das statt der Ribose einen Morpholinring und statt dem Phosphodiester- einen Phosphorodiamidat-Linker enthält.
Eteplirsen stellt die Proteinexpression des Dystrophin-Proteins wieder her, indem das Exon 51 in der prä-mRNA beim Splicing übersprungen beziehungsweise entfernt wird (Exon-Skipping). Dadurch ist das Exon 51 in der mRNA nicht mehr enthalten und wird nicht translatiert. Der Körper ist nun in der Lage, ein verkürztes, aber partiell funktionelles Protein zu bilden. Das Überspringen von Exon 51 verändert den nachgeschalteten Leserahmen von Dystrophin.[6]
Die Krankheit wird damit nicht geheilt, aber der Schweregrad wird reduziert.
Zulassung und Studien
Mehrere klinische Studien wurden durchgeführt, um Eteplirsen zu prüfen: davon
- eine in Großbritannien mit lokaler Injektion in den Fuß,[7][8]
- eine in Großbritannien mit systemischer Injektion bei niedrigen Dosen[5][9] und
- eine in den USA bei höheren systemischen Dosen[10], die sich zu einer Rollover-Verlängerungsstudie entwickelte.[11][12]
In der Phase-II-Studie mit 12 Jungen wurde die Dystrophin-Produktion bei 72 % der Teilnehmer erhöht. Es stellte sich die Frage, ob eine Erhöhung der Dosis – die aufgrund der geringeren Toxizität von Eteplirsen im Vergleich zu Drisapersen möglich ist – den Nichtansprechern zugute käme und ob dies zu erhöhten Nebenwirkungen führen könnte. In den USA hat eine Phase-III-Studie begonnen.[13]
Im Jahr 2011 wurde in einer britischen Studie (AVI-4658) Eteplirsen 19 Kindern mit Duchenne-Muskeldystrophie verabreicht. Die Forscher fanden heraus, dass höhere Dosen des Medikaments zu einem Anstieg des Dystrophins führten. Sie kommen zu dem Ergebnis, dass Medikamente, die den Körper auf diese Weise "überspringen" lassen, zur Behandlung von etwa 83 % der Fälle von Duchenne-Muskeldystrophie eingesetzt werden könnten. Eteplirsen zielt nur auf Mutationen in einer Region, die in 13 % der Fälle betroffen sind. Diese Studie zeigte das Potenzial dieses Ansatzes zur kurzfristigen Erhöhung des Dystrophinspiegels auf. Das Hauptziel der Studie war es, die angemessene Dosierung des Medikaments zu ermitteln, weshalb das Sicherheitsprofil und die Wirkungen des Medikaments in größeren, längerfristigen Studien bestätigt werden müssen, zumal die Patienten es für den Rest ihres Lebens einnehmen müssen (oder bis eine bessere Behandlung verfügbar ist).[5]
Bisher ist die Zulassung nur für die USA erfolgt.[14][2] In Europa wurde die Zulassung verweigert.[3][15]
Im Juli 2012 wechselte das Unternehmen, das Eteplirsen entwickelte, den Namen von AVI BioPharma (davor AntiVirals) in Sarepta Therapeutics. Dadurch laufen verschiedene Studien auf AVI.[16]
Weblinks
- Wissenschaftlicher Beurteilungsbericht zu Exondys des Ausschusses für Humanarzneimittel (CHMP) der europäischen Arzneimittelagentur vom 12. September 2018. (PDF, englisch)
Siehe auch
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- FDA grants accelerated approval to first drug for Duchenne muscular dystrophy, PM FDA vom 19. September 2016, abgerufen am 3. Juli 2018
- Abgelehnte Humanarzneimittel im EU-Gemeinschaftsregister, abgerufen am 5. März 2019.
- Kenji Rowel Q Lim et al.: Eteplirsen in the treatment of Duchenne muscular dystrophy. In: Drug Design, Development and Therapy. 11, Februar 2017, S. 533–545. doi:10.2147/DDDT.S97635.
- Sebahattin Cirak et al.: Exon skipping and dystrophin restoration in patients with Duchenne muscular dystrophy after systemic phosphorodiamidate morpholino oligomer treatment: an open-label, phase 2, dose-escalation study. In: The Lancet. 378, Nr. 9791, 2011, S. 595–605. doi:10.1016/S0140-6736(11)60756-3. PMID 21784508. PMC 3156980 (freier Volltext).
- Karen Anthony et al.: Exon Skipping Quantification by qRT-PCR in Duchenne Muscular Dystrophy Patients Treated with the Antisense Oligomer Eteplirsen. In: Hum Gene Ther Methods.. 23, Nr. 5, 1. Oktober 2012, S. 336–45. doi:10.1089/hgtb.2012.117. PMID 23075107.
- Gary Roper, Manager Clinical Research Governance Organisation, Imperial College London: Safety and Efficacy Study of Antisense Oligonucleotides in Duchenne Muscular Dystrophy. In: ClinicalTrials.gov. US Government, NIH.
- Maria Kinali et al.: Local restoration of dystrophin expression with the morpholino oligomer AVI-4658 in Duchenne muscular dystrophy: A single-blind, placebo-controlled, dose-escalation, proof-of-concept study. In: Lancet Neurol.. 8, Nr. 10, 25. August 2009, S. 918–28. doi:10.1016/S1474-4422(09)70211-X. PMID 19713152. PMC 2755039 (freier Volltext).
- Professor Francesco Muntoni, University College of London Institute of Child Health: Dose-Ranging Study of AVI-4658 to Induce Dystrophin Expression in Selected Duchenne Muscular Dystrophy (DMD) Patients. In: ClinicalTrials.gov. US Government, NIH.
- Sarepta Therapeutics: Efficacy Study of AVI-4658 to Induce Dystrophin Expression in Selected Duchenne Muscular Dystrophy Patients. In: ClinicalTrials.gov. US Government, NIH.
- Jerry Mendell et al.: Eteplirsen for the treatment of duchenne muscular dystrophy. In: Ann. Neurol.. 74, Nr. 5, 2013, S. 637–647. doi:10.1002/ana.23982.
- Sarepta Therapeutics: Efficacy, Safety, and Tolerability Rollover Study of Eteplirsen in Subjects With Duchenne Muscular Dystrophy. In: ClinicalTrials.gov. US Government, NIH. Abgerufen am 30. Oktober 2012.
- Sarepta Therapeutics: Confirmatory Study of Eteplirsen in DMD Patients (PROMOVI). In: ClinicalTrials.gov. US Government, NIH.
- A. Mende: Zulassung für Mittel gegen Duchenne-Dystrophie, Pharmazeutische Zeitung, Ausgabe 39/2016.
- Exondys auf der Website der europäischen Arzneimittelagentur
- FAQs, Company WebSite, abgerufen am 3. Juli 2018