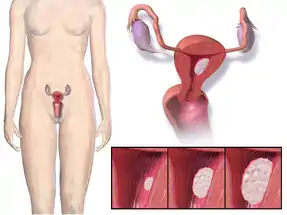
Endometriumkarzinom
Das Endometriumkarzinom, auch Uterus- oder Korpuskarzinom (lat. Carcinoma corporis uteri) ist eine Krebserkrankung der Gebärmutterschleimhaut.
| Klassifikation nach ICD-10 | |
|---|---|
| C54.1 | Bösartige Neubildung des Corpus uteri: Endometrium |
| ICD-10 online (WHO-Version 2019) | |
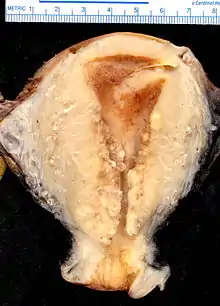
Histologie
.jpg.webp)
Histologisch handelt es sich in 85 % der Fälle um Adenokarzinome der Gebärmutterschleimhaut (Endometrium). Seltene Typen sind z. B. seröse und klarzellige Adenokarzinome oder Plattenepithelkarzinome. Der Grad der Entdifferenzierung (Entartung) der Krebszellen wird mit G1 (hochdifferenziert, dem Normalgewebe sehr ähnlich) bis G3 angegeben. Viele Karzinome exprimieren auf der Zelloberfläche Östrogen- und Progesteron-Rezeptormoleküle.
Stadieneinteilung
Die Einteilung der FIGO und die der UICC sind identisch, sie beruht wie bei anderen soliden Krebserkrankungen auf dem TNM-System.
- Beispiel: Stadium IA (FIGO) = T1a (UICC) = auf die Schleimhaut begrenzter Tumor.
Die Heilungschancen sind davon abhängig: beispielsweise 90 % im Stadium IA, 30 % im Stadium III. Undifferenzierte Tumoren sind schlechter heilbar als hochdifferenzierte.
Stadien nach TNM-Klassifikation und FIGO (Fédération Internationale de Gynécologie et d’Obstétrique):[1][2][3]
| TNM | FIGO | Kriterien |
|---|---|---|
| TX | Primärtumor kann nicht beurteilt werden | |
| T0 | Kein Anhalt für einen Primärtumor | |
| Tis | Carcinoma in situ | |
| T1 | I | Tumor begrenzt auf den Gebärmutterkörper |
| 1a | IA | Tumor begrenzt auf das Endometrium oder infiltriert weniger als die Hälfte des Myometriums |
| 1b | IB | Tumor infiltriert die Hälfte oder mehr des Myometriums |
| T2 | II | Tumor infiltriert das Stroma der Cervix uteri, breitet sich aber nicht jenseits des Uterus aus |
| T3 und/oder N1 | III | lokale und/oder regionale Ausbreitung |
| 3a | IIIA | Tumor befällt die Serosa des Corpus uteri und/oder die Adnexen (direkte Ausbreitung oder Metastasen) |
| 3b | IIIB | Vaginalbefall und/oder Befall der Parametrien (direkte Ausbreitung oder Metastasen) |
| 3c oder N1 | IIIC | Metastasen in Becken- und/oder paraaortalen Lymphknoten |
| 3c1 | IIIC1 | Metastasen in Beckenlymphknoten |
| 3c2 | IIIC2 | Metastasen in paraaortalen Lymphknoten mit/ohne Metastasen in Beckenlymphkoten |
| T4 | IV | Tumor infiltriert Blasen- und/oder Darmschleimhaut |
| Nx | Es kann keine Aussage zu regionären Lymphknotenmetastasen getroffen werden. | |
| N0 | Keine Metastasen in den regionären Lymphknoten. | |
| N1 | Metastasen in den regionären Lymphknoten. | |
| M0 | Keine Fernmetastasen nachweisbar. | |
| M1 | Der Tumor hat Fernmetastasen gebildet. (ausgenommen Vagina, Beckenserosa, Adnexe; einschließlich inguinale und andere abdominale Lymphknoten als paraaortale und/oder Beckenlymphknoten) | |
Molekularbiologie des Endometriumkarzinoms
Über viele Jahrzehnte hielt man Endometriumkarzinome für einen einheitlichen Tumor mit guter Prognose. Östrogen-und Progesteron-Rezeptoren lassen sich in 70–80 % der Fälle nachweisen.[4] Bokham stellte 1983 die Hypothese auf, dass es zwei verschiedene Typen von Endometriumkarzinomen gibt: solche mit und ohne Östrogen- und Progesteronrezeptoren. Beide Typen unterscheiden sich in der Prognose (schlechte Prognose ohne Rezeptoren), Krebsvorstufen (Endometriumhyperplasie als Vorstufe Rezeptor- positiver Tumoren) und Risikoprofilen (Ältere, übergewichtige Tumorpatientinnen: Rezeptor-positiv versus jüngere, schlanke Tumorpatienten: Rezeptor negativ).[5] Inzwischen wurde eine größere Zahl molekulargenetischer Veränderungen untersucht:
| Molekulare Veränderung | Häufigkeit | Funktion | Prognose | Bemerkungen |
|---|---|---|---|---|
| POLE-Mutation | 6 – 12 % | DNA-Reparatur | gut | geringeres Alter, geringerer BMI, höheres Tumorgrading. Hohe Mutationsrate. Starke Lymphozyteninfiltration des Tumors. |
| MMRd | 20 – 40 % | DNA-Reparatur | mittel | Ähnlichkeit mit kolorektalen Karzinomen |
| TP53-Mutation | 9 – 29 % | Tumorsuppressor | schlecht | Ähneln häufig serösen Uteruskarzinomen |
| LICAM-Überexpression | 16 – 28 % | Zelladhäsion / Signalprotein | schlecht | |
| ER/PR-Expression | 72 – 95 % | Östrogen- und Progesteron-Rezeptoren | gut | |
| Wnt-β-Catenin-Pfad | 18 – 15 % | Wnt-Signalweg | mittel | |
| PI3K-AKT-mTOR-Pfad | > 80 % | PI3K/AKT/mTOR-Signalweg | gut bis mittel | Mutation häufiger als bei anderen Malignomen |
| HER2/neu-Überexpression | 14 – 47 % | EGF-Rezeptor (Epidermal growth factor receptor) | schlecht | |
| ARID1A-Mutation | 30 – 40 % | Tumorsuppressor | gut bis mittel |
In Anlehnung an Marnitz.[4][6] Aufgrund des molekulargenetischen Profils lässt sich die Prognose besser abschätzen und die Therapie zielgenau durchführen.
Vorstufen und Frühformen
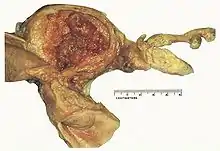
Aufgeschnittenes Uterus-Präparat mit dunkelroten, unregelmäßigen Verdickungen der Schleimhaut
Die Endometriumhyperplasie ohne Atypien ist eine gutartige Erkrankung, die nur bei Symptomatik (zum Beispiel anhaltende Blutung) einer Behandlung bedarf. Diese Schleimhautveränderungen entstehen durch einen anhaltenden Hyperöstrogenismus, bevorzugt bei postmenopausalen, stark übergewichtigen Frauen. Nur etwa 1 % der Patientinnen entwickeln später ein Endometriumkarzinom. Bei der Endometriumhyperplasie mit Atypien dagegen haben bis zu 30 % der Frauen im weiteren Verlauf ein invasives Endometriumkarzinom.[7] Frauen, bei denen nach Feststellung einer Endometriumhyperplasie mit Atypien bei der Ausschabung eine Hysterektomie durchgeführt wurde, fanden dänische Forscher in 59 % der Präparate ein invasives Endometriumkarzinom, in 82 % im Stadium FIGO I.[8] Aus diesem Grund empfiehlt die S3-Leitlinie Endometriumkarzinom[9] bei allen Frauen mit Endometriumhyperplasie mit Atypien eine Hysterektomie, wenn kein Kinderwunsch mehr besteht. Aus der Endometriumhyperplasie mit Atypien entstehen vorwiegend Typ-I-Karzinome, nämlich endometroide und muzinöse Karzinome mit guter Prognose. Molekularbiologisch sind diese Tumoren durch Mutationen von PTEN, K-RAS, Beta-Catenin und Veränderungen im Mismatch-Reparatursystem charakterisiert.[10]
Nach dem dualistischen Modell zur Pathogenese des Endometriums nach Bokhman[11] gibt es noch einen zweiten Weg zur Bildung von Endometriumkarzinomen. Diese sogenannten Typ-II-Karzinome entstehen auf dem Boden eines atrophen Endometriums oder innerhalb von glandulär-zystischen Endometriumpolypen. Zu den Typ-II-Karzinomen gehören auch die serösen und die klarzelligen Karzinome, die eine ungünstige Prognose aufweisen. Molekularbiologisch findet man eine Mutation von TP53, eine Überexpression von Cyclin E und Veränderungen im PIK3CA-Pathway.
Vorkommen
Die Inzidenz von Endometriumkarzinomen ist in Nordamerika und Westeuropa mit 9,9 bis 15 Neuerkrankungen pro 100.000 Frauen und Jahr am höchsten. Die höchste Erkrankungsrate haben die USA. Hier erkranken 1,7 % der Frauen bis zum 75. Lebensjahr.[9] In Deutschland wurden im Jahr 2002 mehr als 11.000 Neudiagnosen gestellt. Die Erkrankungsrate pro Jahr ist in den letzten Jahren gestiegen und liegt momentan bei 25:100.000 Frauen. Betroffen sind überwiegend (ca. 66–85 % je nach Quelle)[12] Frauen im Klimakterium nach der Menopause. 5 % sind jünger als 40. Die Häufigkeit liegt in den westlichen Ländern etwa bei dem Doppelten des Zervixkarzinoms.
Ursachen
Man nimmt an, dass langjährig erhöhte Östrogen-Konzentrationen die Tumorentstehung fördern; z. B. tragen Frauen mit Zyklusstörungen, später Menopause oder Hormonersatztherapie (Östrogen-Monotherapie oder kombinierte Östrogen-Gestagen-Therapie über mehr als sechs Jahre)[13] ein höheres Risiko als der Bevölkerungsdurchschnitt. Die Zivilisationskrankheiten Übergewicht, Bluthochdruck und Diabetes Mellitus II erhöhen das Tumorrisiko. Bekannt ist, dass Adipositas die Östrogenproduktion steigert. Ob eine Gefährdung durch Phytoöstrogene (östrogenartige Substanzen in Nahrungsmitteln) besteht, ist bisher nicht geklärt. Gesichert ist aber, dass eine Hormontherapie ausschließlich mit Östrogenen das Risiko erhöht.
Ursachen für erbliche Anfälligkeit für Endometriumkarzinom sind unter anderem Mutationen in Genen, die für DNA-Mismatch-Reparaturproteine kodieren.
Symptome und Diagnose
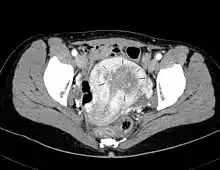
Frühkarzinome können bereits vor dem Auftreten irregulärer Blutungen gelegentlich als Nebenbefunde im Abstrichmaterial bei der Früherkennung zum Gebärmutterhalskrebs entdeckt werden. Die bundesweite Statistik zählt für das Jahr 2015 etwas über 1.600 vorher unbekannte Endometriumkarzinome[14]; das entspricht 15 % der jährlich neu aufgetretenen Malignome. Außerdem macht sich der Tumor schon früh durch Blutungen bemerkbar. Eine Blutung nach Beginn der Menopause ist darum immer verdächtig, wie auch irreguläre Blutungen und fleischwasserfarbener Ausfluss. 75 % aller Endometriumkarzinome werden im ersten Stadium festgestellt.[15] Die 5-Jahres-Überlebensrate liegt dann bei 90 %. Unterleibsschmerzen bedeuten fast immer einen weit fortgeschrittenen, inoperablen Tumor. Die Diagnose wird durch eine Ausschabung der Gebärmutter (Abrasio uteri) gesichert.
In den letzten Jahren hat durch die 3-D-Sonographie die Diagnostik des Endometriumkarzinoms eine Verbesserung erfahren. Durch die Volumensmessung und durch die dreidimensionale Darstellung gelingt es, einerseits das Karzinom genau zu erkennen und andererseits die benignen Veränderungen zu erfassen. Hiermit können überflüssige Eingriffe in Form von Kürettagen vermieden werden. Derzeit sind ca. die Hälfte der Kürettagen vermeidbar.[16]
Behandlung
Wenn immer möglich, sollen Korpuskarzinome operativ entfernt werden. Die Standardoperation erfolgt mittels Unterbauchlängsschnittes oder Bauchspiegelung und umfasst mindestens eine totale Gebärmutterentfernung sowie die Entfernung der Eierstöcke und Eileiter beidseits. Abhängig vom Stadium kann unter anderem die Mitentfernung mindestens der uterusnahen Hälfte vom Gebärmutterbindegewebe, die Mitnahme einer Scheidenmanschette, die Freilegung beider Harnleiter und die Entfernung von Lymphknoten im kleinen Becken (pelvine Lymphadenektomie) und entlang der Bauchaorta bis zum Abgang der Nierenarterien (paraaortale Lymphadenektomie) zusätzlich erforderlich sein (radikale Hysterektomie nach Piver II / III bzw. Wertheim-Meigs-Operation). Höhere Stadien sollten danach eine Strahlentherapie erhalten. Inoperable Tumoren werden nur bestrahlt. Bei serös papillärem und klarzelligem Endometriumkarzinom wird neuerdings eine adjuvante Chemotherapie angewandt.
Prognose
Die Prognose des häufigsten Typs, des endometrioiden Adenokarzinoms, ist mit einer Letalität, also dem Risiko an der Krankheit zu versterben, von 6 % relativ gut. Bei den anderen Arten schwankt die Letalität zwischen 21 % und 51 %. Wie bei allen Tumoren verschlechtert auch eine fehlende Differenzierung der Zellen, d. h. eine große Veränderung der ursprünglichen Drüsenzellen, die Prognose. Im Schnitt überleben 80 % der Erkrankten fünf Jahre nach Diagnosestellung.[15] In Stadium I sind es sogar 90 %, in Stadium II 83 %, im Stadium III 43 %. Nach zwei Jahren wird ein Rezidiv, also ein erneutes Wachstum von Tumorzellen, unwahrscheinlich. Allerdings bleibt für den Rest des Lebens ein erhöhtes Risiko, ein Mammakarzinom zu entwickeln.
Siehe auch
Weblinks
- S3-Leitlinie Diagnostik, Therapie und Nachsorge der Patientinnen mit Endometriumkarzinom der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe (DGGG). In: AWMF online (Stand 04/2018)
- Dissertation zum Thema. (PDF; 6,1 MB)
Literatur
- Klaus Diedrich, Wolfgang Holzgreve, Walter Jonat, Askan Schultze-Mosgau, Klaus-Theo M. Schneider: Gynäkologie und Geburtshilfe. Springer Verlag, 2006, ISBN 3-540-32867-X (Volltext in der Google-Buchsuche).
- Dominik Denschlag, Uwe Ulrich, Günter Emons: Diagnostik und Therapie des Endometriumkarzinoms: Fortschritt und Kontroversen. In: Dtsch Arztebl Int. Nr. 108(34-35), 2011, S. 571–577 (Übersichtsarbeit).
Einzelnachweise
- L.-C. Horn, K. Schierle, D. Schmidt, U. Ulrich: Neues TNM/FIGO-Staging-System für das Zervix- und Endometriumkarzinom sowie maligne Müller’sche Mischtumoren (MMMT) des Uterus. In: Geburtsh Frauenheilk. 69, 2009, S. 1078–1081, doi:10.1055/s-0029-1240644
- L.-C. Horn, K. Schierle, D. Schmidt, U. Ulrich, A. Liebmann, C. Wittekind: Aktualisiertes TNM/FIGO-Staging-System für das Zervix- und Endometriumkarzinom sowie maligne Müller’sche Mischtumoren (MMMT) des Uterus. Fakten und Hintergrund. In: Pathologe. 2011, PMID 20084383
- Stadieneinteilung des Endometriumkarzinoms seit 2010 in der neuen Leitlinie zur Diagnostik und Behandlung des Endometriumkarzinoms veröffentlicht von der AGO (Arbeitsgemeinschaft Gynäkologische Onkologie)
- S. Marnitz, T. Waltar, C. Köhler, A. Mustea, B. Schömig-Markiefka: The brave new world of endometrial cancer: Future implications for adjuvant treatment decisions. In: Strahlentherapie und Onkologie. Band 196, Nr. 11, November 2020, ISSN 0179-7158, S. 963–972, doi:10.1007/s00066-020-01632-w.
- J. V. Bokhman: Two pathogenetic types of endometrial carcinoma. In: Gynecologic Oncology. Band 15, Nr. 1, Februar 1983, ISSN 0090-8258, S. 10–17, doi:10.1016/0090-8258(83)90111-7, PMID 6822361.
- Bastiaan G. Wortman, Remi A. Nout, Tjalling Bosse, Carien L. Creutzberg: Selecting Adjuvant Treatment for Endometrial Carcinoma Using Molecular Risk Factors. In: Current Oncology Reports. Band 21, Nr. 9, September 2019, ISSN 1523-3790, S. 83, doi:10.1007/s11912-019-0825-z, PMID 31367798, PMC 6669195 (freier Volltext).
- R Zaino, S G Garinelli, L H Ellenson: Tumors of the uterine Corpus: epithelial Tumours and Precursors. In: C M Kurmann, C S Harrington, Joung R H (Hrsg.): WHO Classification of Tumours of the Female Reproductive Tract. IARC Press, Lyon, 2014, S. 125–126 (englisch).
- Sofie Leisby Antonsen, Lian Ulrich, Claus Høgdall: Patients with atypical hyperplasia of the endometrium should be treated in oncological centers. In: Gynecologic Oncology. Band 125, Nr. 1, 2012, ISSN 1095-6859, S. 124–128, doi:10.1016/j.ygyno.2011.12.436, PMID 22198048.
- Leitlinienprogramm Onkologie (Deutsche Krebshilfe, AWMF): Diagnostik, Therapie und Nachsorge der Patientinnen mit Endometriumkarzinom, Langversion 1.0, 2018. 2018, abgerufen am 26. Juli 2019.
- X Matias-Guiu, L Catasus, E Bussaglia, H Lagarda, A Garcia: Molecular pathology of endometrial hyperplasia and carcinoma. In: Human Pathology. Band 32, Nr. 6, 2001, ISSN 0046-8177, S. 569–577, doi:10.1053/hupa.2001.25929, PMID 11431710.
- J V Bokhman: Two pathogenetic types of endometrial carcinoma. In: Gynecologic Oncology. Band 15, Nr. 1, 1983, ISSN 0090-8258, S. 10–17, PMID 6822361.
- K. Diedrich u. a.: Gynäkologie und Geburtshilfe. 2. Auflage. Springer Verlag, 2007, S. 240.
- DGGG, Deutsche Krebsgesellschaft und andere: S3-Leitlinie Diagnostik, Therapie und Nachsorge der Patientinnen mit Endometriumkarzinom. Hrsg.: AWMF-Reg.Nr. 032/034. 2018 (awmf.org [PDF]).
- Markquardt K., I. Kossowski, R. Pfandzelter: Mpnchner Nomenklatur III. Bundesweite Jahresstatistik nach Nomenklaturreform. In: FRAUENARZT 58(2017), 9, S 706 ff. (frauenarzt.de).
- K. A. Nicolaije u. a.: Follow-up practice in endometrial cancer and the association with patient and hospital characteristics: A study from the population-based PROFILES registry. In: Gynecologic Oncology. 129 (2), 2013, S. 324–331, PMID 23435365
- C. Yaman, A. Habelsberger, G. Tews, W. Pölz, T. Ebner: The role of three-dimensional volume measurement in diagnosing endometrial cancer in patients with postmenopausal bleeding. In: Gynecol Oncol. 2008 Sep;110(3), S. 390–395. doi:10.1016/j.ygyno.2008.04.029. Epub 2008 Jun 24.