Elektronenverschiebung
Unter Elektronenverschiebung versteht man im Allgemeinen die Bewegung eines einzelnen Elektrons oder eines Elektronenpaars, die im Verlauf einer chemischen Reaktion stattfindet. Zur Veranschaulichung wird die Verschiebung mithilfe von gebogenen Pfeilen () dargestellt. Dabei wird die Bewegung eines Elektrons oder Elektronenpaars von einem besetzten in ein freies Orbital illustriert.[1] Diese Technik wurde 1922 von Robert Robinson entwickelt und findet seither vielfach Anwendung in der Darstellung von Reaktionsmechanismen.[2] Bei chemischen Reaktionen spielt die Überlappung und Addition von Molekülorbitalen zu neuen Molekülorbitalen, sowie die Bewegung der Elektronen innerhalb dieser Orbitale eine wichtige Rolle. Mithilfe der gebogenen Pfeile können wichtige Merkmale dieser Wechselwirkungen und Elektronenbewegungen dargestellt werden. Es ist zu beachten, dass dieser Formalismus lediglich eine Vereinfachung darstellt und die Verschiebung von Elektronen bzw. der Elektronendichte in Wirklichkeit nicht so sauber Schritt für Schritt verläuft.[1]
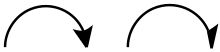
Darstellung von Elektronenverschiebungen
In der organischen Chemie werden zwei Arten von gebogenen Pfeilen zur Darstellung von Elektronenverschiebung genutzt, da zwischen der Verschiebung eines Elektronenpaars und der Verschiebung eines einzelnen Elektrons unterschieden wird.

Elektronenpaarverschiebung
Der gebogene Pfeil mit einer zweizackigen Pfeilspitze veranschaulicht die Bewegung von zwei Elektronen (einem Elektronenpaar) von einem besetzten in ein freies Orbital. Sie gehen also von einem elektronenreichen Zentrum aus und reichen bis zu einem elektronenarmen Zentrum.[1][3] Bei der Darstellung von Reaktionsmechanismen geht der Pfeil folglich von einem freien Elektronenpaar an einem Atom oder von einer Elektronenpaarbindung aus. Die Pfeilspitze zeigt meistens auf das Atom, zu dem die neue Bindung gebildet wird.[1]

Einelektronenverschiebung
Die Einelektronenverschiebung wird durch angelhakenförmige, einzackige Pfeile dargestellt. Da die Übertragung einzelner Elektronen zur Radikalbildung führt, werden diese Pfeile auch als Radikalpfeile bezeichnet.[4]

Bindungsspaltung
Die Produkte einer chemischen Reaktion sind das Resultat eines Prozesses, in welchem Bindungen gebrochen und neue Bindungen geformt werden. Bindungen zwischen zwei Atomen können als ein Set, bestehend aus zwei Elektronen, also einem Elektronenpaar, gesehen werden. Eine Einfachbindung setzt sich demnach aus zwei Elektronen, eine Doppelbindung aus vier Elektronen und eine Dreifachbindung aus sechs Elektronen zusammen.
Im Allgemeinen werden drei Wege der Bindungsspaltung unterschieden: Die heterolytische Bindungsspaltung, die homolytische Bindungsspaltung und Umlagerungen, wie sie bei pericyclischen Reaktionen auftreten.[5]
Heterolytische Bindungsspaltung
Von einer heterolytischen Bindungsspaltung (Heterolyse) wird gesprochen, wenn die beiden Bindungselektronen ausschließlich bei einem der beiden beteiligten Atome verbleiben. Dies führt zur Bildung von Ionen, wobei das Fragment, welches die Bindungselektronen erhält, negativ geladen ist. Das andere Fragment erhält eine positive Ladung.[4][5]

Homolytische Bindungsspaltung
Bei der homolytischen Bindungsspaltung (Homolyse) wird die Elektronendichte nach der Spaltung gleichwertig auf beide beteiligten Atome verteilt. Jedes Atom erhält ein Bindungselektron. Die Produkte der Homolyse sind Radikale, die ein ungepaartes Elektron haben, welches durch einen Punkt am Atomsymbol gekennzeichnet wird. Bei Radikalen kann es sich um Atome und Moleküle handeln.[4]
Pericyclische Reaktionen
Bei den pericyclischen Reaktionen wandern die Elektronen im Kreis. Bei Betrachtung des Reaktionsmechanismus zeigt sich dies, indem die Pfeile einen Ring nachvollziehen und dort enden, wo sie begonnen haben. Die Bindungen werden simultan gebrochen und gebildet, sodass keine Zwischenstufen (und damit auch keine positiven oder negativen Ladungen an Zwischenstufen) vorliegen. Das untenstehende Beispiel der Cope-Umlagerung (R = Rest) illustriert dieses Reaktionsverhalten, bei dem weder freie Radikale noch Ionen involviert sind.[5][6]
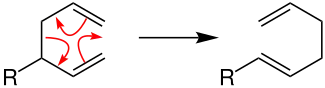
Ein anderes bekanntes Beispiel für eine pericyclische Reaktion ist die Diels-Alder-Reaktion.[6]
Weitere Beispiele für Elektronenverschiebungen in der Chemie
π-Elektronenverschiebung bei Farbstoffen
Sind in einem Molekül mehrere konjugierte Doppelbindungen enthalten, können die π-Elektronen innerhalb des Systems verschoben werden, es kommt zur Delokalisierung. Je stärker konjugiert eine Verbindung ist, desto geringer ist der Energieunterschied zwischen dem höchsten mit Elektronen besetzten (HOMO) und dem niegrigsten unbesetzten Molekülorbital (LUMO). Dadurch wird der energetische Abstand zwischen dem Grundzustand und dem angeregten Energiezustand des Moleküls verringert, die Verbindung absorbiert bei höheren Wellenlängen und erscheint dadurch farbig (bathochromer Effekt).[7][8] Der Azofarbstoff 4-Aminoazobenzol wird daher beispielsweise in einer gelben Farbe wahrgenommen.[9]

Ausbildung von Partialladungen
Unterscheiden sich die Bindungspartner einer Atombindung in ihrer Elektronegativität, kommt es zu einer Verschiebung der Elektronendichte zugunsten des elektronegativeren Atoms. Je höher also die Elektronegativität eines Atoms, desto stärker zieht es die Elektronendichte in einer Bindung an sich. Dies führt zur Ausbildung von Partialladungen, die mit δ+ und δ– oberhalb des Elementsymbols gekennzeichnet werden.[10]
Literatur
- Jonathan Clayden, Nick Greeves, Stuart Warren: Organische Chemie. 2. Auflage. Springer Spektrum, Berlin / Heidelberg 2013, ISBN 978-3-642-34715-3.
- Daniel E. Levy: Arrow pushing in organic chemistry : an easy approach to understanding reaction mechanismus. Wiley, Hoboken, N.J. 2008, ISBN 978-0-470-17110-3.
Einzelnachweise
- Jonathan Clayden, Nick Greeves, Stuart Warren: Organische Chemie. 2. Auflage. Springer Spektrum, Berlin / Heidelberg 2013, ISBN 978-3-642-34715-3, S. 129–130.
- William Ogilvy Kermack, Robert Robinson: LI.—An explanation of the property of induced polarity of atoms and an interpretation of the theory of partial valencies on an electronic basis. In: J. Chem. Soc., Trans. Band 121, 1922, S. 427–440, doi:10.1039/ct9222100427.
- Paula Y. Bruice: Organische Chemie : Studieren kompakt. 5. Auflage. Pearson Studium, Barcelona 2011, ISBN 978-3-86894-102-9, S. 135.
- Jonathan Clayden, Nick Greeves, Stuart Warren: Organische Chemie. 2. Auflage. Springer Spektrum, Berlin / Heidelberg 2013, ISBN 978-3-642-34715-3, S. 1064–1065.
- Daniel E. Levy: Arrow pushing in organic chemistry : an easy approach to understanding reaction mechanisms. Wiley, Hoboken, N.J. 2008, ISBN 978-0-470-17110-3, S. 1–5.
- Jonathan Clayden, Nick Greeves, Stuart Warren: Organische Chemie. 2. Auflage. Springer Spektrum, Berlin / Heidelberg 2013, ISBN 978-3-642-34715-3, S. 490; 961–963.
- K. Peter, C. Vollhardt: Organische Chemie. 1. Auflage. VCH, Weinheim 1988, ISBN 3-527-26912-6, S. 618.
- Jonathan Clayden, Nick Greeves, Stuart Warren: Organische Chemie. 2. Auflage. Springer Spektrum, Berlin / Heidelberg 2013, ISBN 978-3-642-34715-3, S. 165.
- Eintrag zu 4-Aminoazobenzol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 24. November 2018.
- Jonathan Clayden, Nick Greeves, Stuart Warren: Organische Chemie. 2. Auflage. Springer Spektrum, Berlin / Heidelberg 2013, ISBN 978-3-642-34715-3, S. 204.