Cope-Umlagerung
Die Cope-Umlagerung ist eine Reaktion aus dem Bereich der Organischen Chemie, die auf den US-amerikanischen Chemiker Arthur C. Cope (1909–1966) zurückgeht. Sie ist die erste entdeckte Festphasensynthese innerhalb der organischen Chemie.[2] Es handelt sich um eine reversible thermische Isomerisierung von 1,5-Dienen und gehört zu den pericyclischen Reaktionen. Die Cope-Umlagerung ist eine sigmatrope [3,3] Verschiebung.[3]


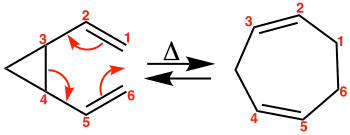
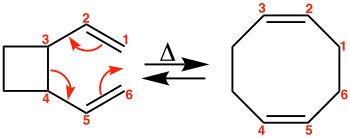
Beispiele
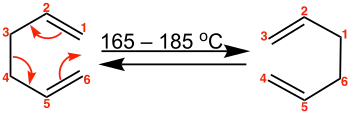
In Abb. 1 ist die Reaktion am Beispiel von 1,5-Hexadien illustriert. Die Cope-Umlagerung von unsubstituiertem 1,5-Hexadien liefert wieder 1,5-Hexadien. Dies ist ein Beispiel für eine entartete Reaktion, bei der Edukt und Produkt identisch sind.
In Abb. 2 ist die Umlagerung der meso-Form eines 3,4-disubstituierten 1,5-Hexadiens beschrieben; Abb. 3 zeigt die Umlagerung des Racemats eines 3,4-disubstituierten 1,5-Hexadiens. Die Reaktion läuft also stereospezifisch und stereoselektiv ab.[1] Beispiele zur Synthese großer Ringe finden sich in Abb. 4 und Abb. 5.
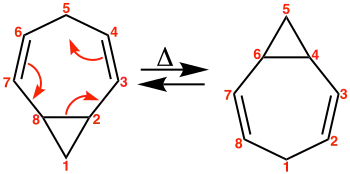
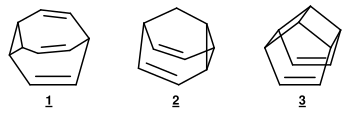
Weitere Verbindungen, die das Phänomen der entarteten Cope-Umlagerung zeigen, sind 3,4-Homotropiliden (Abb. 6), die überbrückten Homotropiliden-Derivate Bullvalen und Barbaralan, sowie Hypostrophen (Abb. 7). Man bezeichnet diese Moleküle mit fluktuierenden Bindungen als Valenztautomere.[4]
Ähnliche Reaktionen
- Diaza-Cope-Umlagerung
- Claisen-Umlagerung (Oxa-Cope-Umlagerung)
Einzelnachweise
- László Kürti und Barbara Czakó.: Strategic Applications of Named Reactions in Organic Synthesis: Background and Detailed Mechanisms, Elsevier Academic Press, 2005, ISBN 978-0-12-429785-2, S. 98–99.
- V. K. Ahluwalia: Strategies for Green Organic Synthesis. 1. Auflage. Ane Books Pvt. Ltd., New Delhi 2012, ISBN 978-1-4398-7050-1, S. 8.
- Hans Rudolf Christen: Grundlagen der Organischen Chemie, 5. Auflage, 1982, S. 575 ff, Otto Salle Verlag, Frankfurt, ISBN 3-7935-5395-7.
- Eberhard Breitmaier, Günther Jung: Organische Chemie: Grundlagen, Stoffklassen, Reaktionen, Konzepte, Molekülstruktur, S. 452 Verlag: Thieme; 6. Auflage, 2009, ISBN 978-3-13-541506-2.
Weiterführende Literatur
- Arthur C. Cope, Elizabeth M. Hardy: The Introduction of Substituted Vinyl Groups. V. A Rearrangement Involving the Migration of an Allyl Group in a Three-Carbon System1. In: Journal of the American Chemical Society. 62, Nr. 2, 1940, S. 441–444, doi:10.1021/ja01859a055.
- Ian Fleming: Grenzorbitale und Reaktionen organischer Verbindungen. (= Frontier orbitals and organic chemical reactions.) 1. Auflage, korrigierter Nachdr., VCH, Weinheim 1988, ISBN 3-527-25792-6.
- T. H. Lowry, K. S. Richardson Mechanismen und Theorie in der Organischen Chemie. Verlag Chemie, Basel 1980, ISBN 3-527-25795-0, S. 735 ff.
Weblinks
- chemiestudent.de: Namensreaktionen und Beispiel für die Cope-Umlagerung
- organische-chemie.ch: Namensreaktionen und aktuelle Literaturbeispiele