Dronedaron
Dronedaron (Handelsname Multaq) ist der Freiname eines Arzneistoffes, der als Antiarrhythmikum zur Behandlung von Herzrhythmusstörungen eingesetzt wird.[3] Das Medikament wird als 400-mg-Tabletten von Sanofi produziert und vermarktet. Die empfohlene Dosierung ist eine zweimal tägliche Einnahme von 400 mg.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
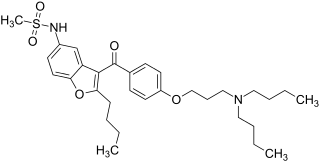 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Dronedaron | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C31H44N2O5S | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
C01BD | |||||||||||||||||||||
| Wirkstoffklasse |
Klasse III Antiarrhythmika | |||||||||||||||||||||
| Wirkmechanismus |
| |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 556,76 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Chemie
Als Benzofuranderivat ähnelt Dronedaron in der chemischen Struktur und der Wirkung dem Amiodaron. Amiodaron ist der am weitesten angewandte Arzneistoff für die Wiederherstellung und die Aufrechterhaltung des Sinusrhythmus bei Herzrhythmusstörungen, hat allerdings erhebliche systemische Nebenwirkungen.[4] Dronedaron ist eine Weiterentwicklung des Amiodarons und wurde entwickelt, um diese Nebenwirkungen zu reduzieren.[5][6] Im Gegensatz zu Amiodaron besitzt Dronedaron keine Jodkomponenten und ist weniger lipophil. Es wird nach oraler Einnahme zu 70–94 % resorbiert, was durch die Gabe zusammen mit Essen erhöht werden kann.
Pharmakologie
Wirkmechanismus und Indikationen
Im Erregungsleitungssystem des Herzens blockiert der Arzneistoff die Natrium-, Kalium- und Calciumkanäle („multi channel blocker“) und wirkt antiadrenerg.[1] Von der amerikanischen Zulassungsbehörde FDA wurde es für die Behandlung von Patienten mit paroxysmalen oder persistierendem Vorhofflimmern, die sich im Sinusrhythmus befinden oder kardiovertiert werden nach einer Episode von Vorhofflimmern oder -flattern bei assoziierten weiteren kardiovaskulären Risikofaktoren wie hohes Alter, Bluthochdruck, Diabetes etc. zugelassen.[7] Gemäß der Zulassung der EMEA ist Dronedaron „angezeigt bei erwachsenen, klinisch stabilen Patienten mit nicht-permanentem Vorhofflimmern (VHF) (aktuell bestehend oder in der Vorgeschichte), um ein Wiederauftreten von Vorhofflimmern zu verhindern oder die ventrikuläre Herzfrequenz zu senken“.[8] In einem Rote Hand Brief vom September 2011 wird die Indikation reduziert auf „erwachsene, klinisch stabile Patienten mit paroxysmalem oder persistierendem Vorhofflimmern (VHF) zum Erhalt des Sinusrhythmus nach einer erfolgreichen Kardioversion“.[9]
Metabolisierung
Dronedaron wird über den Cytochrom-P450 3A (CYP3A) Stoffwechselweg in der Leber metabolisiert und ist ein mittelstarker Hemmstoff (Inhibitor) von CYP3A, sowie von CYP2D6.[7] Es hat keine signifikanten Effekte gegen die anderen Cytochrom-Komponenten CYP1A2, CYP2C9, CYP2C19, CYP2C8 und CYP2B6. Die Eliminationshalbwertzeit im Körper liegt bei 13–19 Stunden.[7]
Wechselwirkungen mit anderen Medikamenten
Dronedaron hat potentiell wichtige pharmadynamische Interaktionen mit anderen Antiarrhythmika, Digoxin, Calcium-Kanal-Blockern, Beta-Blockern, CYP3A induzierenden Medikamenten, Grapefruitsaft, Statinen, CYP3A-Substraten mit einem engen therapeutischen Index (z. B. Sirolimus, Tacrolimus).[7]
Nebenwirkungen
Da Dronedaron keine Iod-Komponente enthält, sind die für Amiodaron typischen und mit Iod assoziierten Nebenwirkungen (Über- und Unterfunktionen der Schilddrüse) nicht zu erwarten. In den Zulassungsstudien traten unerwünschte Arzneimittelwirkungen nicht häufiger auf als unter Placebo. Die Medikamentenbeilage weist auf folgende Nebenwirkungen hin: verringerter Herzschlag (Bradykardie), Magenprobleme (Durchfall, Übelkeit, Erbrechen, abdominale Schmerzen, Verdauungsprobleme), Müdigkeit und Schwächegefühl, Hautreizungen (Rötung, Ausschlag, Juckreiz).[7] Im Januar 2011 gab die US-Arzneimittelbehörde FDA eine Warnung bezüglich des Auftretens schwerer Leberschäden unter Dronedaronbehandlung heraus. Diese Nebenwirkung träte selten auf, könne aber zu einem lebensgefährlichen Leberschaden führen. Die FDA empfiehlt deshalb eine regelmäßige Überwachung der Leberwerte, insbesondere in den ersten sechs Monaten der Therapie.[10]
Zulassung
Historie
Dronedaron wurde im Juli 2009 aufgrund der Ergebnisse der ATHENA-Studie nach einem beschleunigten Zulassungsverfahren von der Food and Drug Administration (FDA) zugelassen;[11] es folgte die Zulassung in Kanada, in der Schweiz[12] und im November 2009 in den Ländern der EU.[13]
Studien
Dronedaron wurde in einem umfangreichen klinischen Studienprogramm, dessen Ergebnisse überwiegend publiziert sind, auf seine Wirkung zur Rhythmuskontrolle, aber auch zur Frequenzkontrolle untersucht.
DAFNE
Die klinische Phase-II-Studie („Dronedarone Atrial Fibrillation study after Electrical Cardioversion“, DAFNE) wurde zur Ermittlung der optimalen Dronedaron-Dosierung durchgeführt.[14] Patienten (n=199) mit persistierendem Vorhofflimmern wurden nach Kardioversion mit 800, 1200, oder 1600 mg Dronedaron oder mit Placebo behandelt und über die darauffolgenden 6 Monate beobachtet. Die Zeit bis zum erneuten Auftreten von Vorhofflimmern lag in der mit Dronedaron behandelten Gruppe mit 60 Tagen deutlich höher als in der Placebogruppe (5,3 Tage). Eine erhöhte Dosis Dronedaron zeigte keine signifikanten Unterschiede. Nach 6 Monaten waren 10 % der mit Placebo behandelten Patienten und 35 % der mit Dronedaron behandelten Patienten noch im Sinusrhythmus. Es wurden keine proarrhythmischen Effekte beobachtet.
EURIDIS und ADONIS
In zwei Studien („European Trial in Atrial Fibrillation or Flutter Patients Receiving Dronedarone for the Maintenance of Sinus Rhythm“, EURIDIS und „American-Australian Trial with Dronedarone in Atrial Fibrillation or Flutter Patients for the Maintenance of Sinus Rhythm“, ADONIS) mit insgesamt 1237 Studienteilnehmern, konnte bei Patienten mit Vorhofflimmern oder Herzrhythmusstörungen (n = 828) eine vorteilhafte Wirkung bei der Gabe von zweimal 400 mg Dronedaron pro Tag nachgewiesen werden. Beide Studien starteten im November 2001, EURIDIS endete im August und ADONIS im September 2003. Die Patienten wurden über einen Zeitraum von 12 Monaten beobachtet. Patienten in beiden Studienarmen wurden zusätzlich mit verschiedenen Standardmedikamenten gegen Vorhofflimmern behandelt. Im Vergleich mit einem Placebo (n = 409) traten bei Dronedaron-Behandlung weniger Episoden von Vorhofflimmern auf und während der Episoden war die Pulsfrequenz geringer. Des Weiteren war das erneute Auftreten von Herzrhythmusstörungen bei Dronedaron behandelten Patienten um 25 % verzögert. Das Auftreten von pulmonalen toxischen Nebenwirkungen, sowie Schilddrüsen- oder Leberfunktionsstörungen war unter Dronedaron nicht signifikant erhöht. Beide Studien wurden gemeinsam publiziert.[15]
ANDROMEDA
In der Studie ANDROMEDA sollte bei ca. 1000 Patienten mit hohem Risiko für frühzeitigen Herztod untersucht werden, ob Dronedaron eine positive Wirkung bei herzinsuffizienten Patienten zeigt (Vorhofflimmern musste bei diesen Patienten nicht vorliegen). Die Studie startete im Juni 2002, wurde allerdings nach dem Einschluss von 627 Patienten im August 2003 vorzeitig abgebrochen, da die Therapie bei schwer herzinsuffizienten Patienten zu einer erhöhten Sterblichkeit führte. Die meisten Todesfälle waren die Folge der Verschlechterung der Herzinsuffizienz und nicht arrhythmiebedingt.[16] Um dieses Risiko auszuschließen, wurde in der Zulassung der FDA unter anderem die Behandlung von herzinsuffizienten Patienten der New York Heart Association (NYHA-)Klasse IV ausgeschlossen.
ERATO
Die Studie “European Study of Dronedarone in Atrial Fibrillation” (ERATO) begann im August 2002 und endete im Juni 2004.[17] Insgesamt wurden 174 Patienten mit permanentem Vorhofflimmern zusätzlich zur Standardtherapie entweder mit Dronedaron (zweimal täglich 400 mg) (n=85) oder mit Placebo (n=89) über einen Zeitraum von sechs Monaten behandelt. Die Studie zeigte, dass Dronedaron die durchschnittliche Herzfrequenz im Vergleich zu der mit Placebo behandelten Gruppe um 11,7 Schläge pro Minute verringerte. Somit wurde gezeigt, dass Dronedaron zusätzlich zu seinen antiarrhythmischen Effekten auch zu der angestrebten Verminderung der Herzfrequenz bei Patienten mit permanentem Vorhofflimmern führt. Dronedaron wurde gut vertragen, da sich die Häufigkeit der verschiedenen Nebenwirkungen nicht von der in der Placebogruppe unterschied.
DIONYSOS
Die Studie über “Efficacy & Safety of Dronedarone Versus Amiodarone for the Maintenance of Sinus Rhythm in Patients With Atrial Fibrillation” (DIONYSOS) war die erste direkte Vergleichsstudie zwischen Dronedaron und Amiodaron. Sie begann im Juni 2007 und wurde im Oktober 2008 beendet.[18] In dieser Studie wurden 505 Patienten entweder mit Dronedarone (400 mg BID) oder mit Amiodarone (600 mg täglich für 28 Tage, dann 200 mg täglich) behandelt und die Aufrechterhaltung von Sinusrhythmus bei Patienten mit persistierendem Vorhofflimmern >72 Stunden nach primär erfolgreicher Kardioversion wurde verglichen. Vorläufige Ergebnisse zeigen, dass es im mit Dronedaron behandelten Studienarm bei 36,5 % der Patienten zu wiederkehrendem Vorhofflimmern, im Gegensatz zu 24,3 % in der Amiodaron behandelten Gruppe kam. Obwohl Amiodaron in diesem Aspekt effektiver war, zeigte Dronedaron eine deutlich geringere Toxizität auf und rief weniger Nebeneffekte hervor.[18]
ATHENA
Die „Prevention of Cardiovascular Hospitalization or Death From Any Cause in Patients with Atrial Fibrillation/Atrial Flutter“ (ATHENA-)Studie wurde im Zeitraum von Juni 2005 bis Januar 2008 durchgeführt. Es wurde an 4628 älteren Patienten (Dronedaron-Arm n=2301, Placebo-Arm n=2327) untersucht, ob Dronedaron einen positiven Einfluss auf die Mortalität und Morbidität von Risikopatienten mit Vorhofflimmern hat. Die Patienten hatten mindestens einen Risikofaktor wie Diabetes mellitus, Bluthochdruck, oder verminderte Herzleistung. Die placebokontrollierte internationale Studie ergab, dass im Untersuchungszeitraum von durchschnittlich 21 Monaten der primäre Endpunkt „Tod oder Krankenhauseinweisungen wegen kardiovaskulärer Ereignisse“ unter Dronedaron mit 31,9 % seltener als unter Placebo (39,4 %) auftrat. Auch arrhythmiebedingte Todesfälle kamen unter Dronedaron seltener vor. Auch in ATHENA wurden beide Studienarme zusätzlich mit verschiedenen Standardmedikamenten gegen Vorhofflimmern behandelt.[1][19] Des Weiteren zeigte die ATHENA-Studie in vorab nicht geplanten (Post-hoc)-Analysen, dass das Risiko für das Auftreten eines Schlaganfalls im mit Dronedaron behandelten Studienarm mit 1,2 % pro Jahr geringer war als das Risiko im Kontrollarm (1,8 % pro Jahr).[20]
PALLAS
Hersteller und die europäische Arzneimittelbehörde (EMA) teilten im Juli 2011 mit, dass die PALLAS-Studie aufgrund von schwerwiegenden kardiovaskulären Ereignissen bei Patienten, die Dronedaron eingenommen hatten, abgebrochen wurde. Mit der Studie sollte der Einfluss von Dronedaron als Zusatz zur Standardtherapie auf die Rate von kardiovaskulären Ereignissen oder Todesfällen bei Patienten über 65 Jahre mit permanentem Vorhofflimmern gegenüber Placebo untersucht werden. Der Ausschuss für Humanarzneimittel (CHMP) bei der EMA will noch im Juli 2011 über die Notwendigkeit weiterer Maßnahmen entscheiden.[21] Die US-amerikanische Gesundheitsbehörde (FDA) veröffentlichte im Dezember 2011 ein entsprechendes Safety Announcement („erhöhtes Sterberisiko und ernsthafte kardiovaskuläre Nebenwirkungen“).[22]
Einzelnachweise
- Beschleunigte Zulassung für Dronedaron. In: Pharmazeutische Zeitung. Nr. 34, 2008, S. 26 (online).
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von N-(2-Butyl-3-{p-[3-(dibutylamino)propoxy]benzoyl}-5-benzofuranyl)methane sulfonamide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 2. März 2016.
- Wolfram Domschke: Therapie-Handbuch Innere Medizin. Elsevier, Urban&Fischer Verlag, 2011, ISBN 978-3-437-22702-8, S. 58 (eingeschränkte Vorschau in der Google-Buchsuche).
- Richard L. Page, Bashar Hamad, Peter Kirkpatrick: Dronedarone. In: Nature Reviews Drug Discovery. Band 8, Nr. 10, 2009, S. 769–770, doi:10.1038/nrd2998.
- A. Manning et al.: SR 33589, a new amiodarone-like antiarrhythmic agent: electrophysiological effects in anesthetized dogs. In: J Cardiovasc Pharmacol. 25, S. 252–261, 1995, PMID 8583788.
- O. Finance et al.: Effects of a new amiodarone-like agent, SR 33589, in comparison to amiodarone, D,L-sotalol, and lignocaine, on ischemia-induced ventricular arrhythmias in anesthetized pigs. In: J Cardiovasc Pharmacol. 26, S. 570–576, 1995, PMID 8569217.
- US Prescribing Information Multaq (Memento vom 27. April 2011 im Internet Archive) (PDF; 271 kB).
- JC Laughlin, PR Kowey: Dronedarone: a new treatment for atrial fibrillation. In: J. Cardiovasc. Electrophysiol.. 19, Nr. 11, November 2008, S. 1220–6. doi:10.1111/j.1540-8167.2008.01251.x. PMID 18702618.
- Information über eine Einschränkung der Anwendung von Multaq (Dronedaron) (PDF; 629 kB) Sanofi-Aventis
- Medikamentensicherheitsmitteilung. FDA, 14. Januar 2010; abgerufen am 18. Januar 2010.
- FDA Approves Multaq to Treat Heart Rhythm Disorder. FDA, 2. Juli 2009.
- Brigitte M. Gensthaler, Kerstin A. Gräfe, Sven Siebenand: Neu auf dem Markt: Dronedaron, Indacaterol und Prucaloprid. In: Pharmazeutische Zeitung. Nr. 5, 2010 (online).
- Sanofi erhält Multaq-Zulassung. apotheke ad-hoc, 30. November 2009.
- Paul Touboul, Josep Brugada, Alessandro Capucci, Harry J. G. M. Crijns, Nils Edvardsson, Stefan H. Hohnloser: Dronedarone for prevention of atrial fibrillation: A dose-ranging study. In: European Heart Journal. Band 24, Nr. 16, 2003, S. 1481–1487, doi:10.1016/S0195-668X(03)00321-X (freier Volltext).
- Bramah N. Singh, Stuart J. Connolly, Harry J. G. M. Crijns, Denis Roy, Peter R. Kowey, Alessandro Capucci, David Radzik, Etienne M. Aliot, Stefan H. Hohnloser: Dronedarone for Maintenance of Sinus Rhythm in Atrial Fibrillation or Flutter. In: New England Journal of Medicine. Band 357, Nr. 10, 2007, S. 987–999, doi:10.1056/NEJMoa054686, PMID 17804843 (freier Volltext).
- Lars Køber, Christian Torp-Pedersen, John J. V. McMurray, Ole Gøtzsche, Samuel Lévy, Harry Crijns, Jan Amlie, Jan Carlsen: Increased Mortality after Dronedarone Therapy for Severe Heart Failure. In: New England Journal of Medicine. Band 358, Nr. 25, 2008, S. 2678–2687, doi:10.1056/NEJMoa0800456, PMID 18565860 (freier Volltext).
- J. M. Davy et al.: Dronedarone for the control of ventricular rate in permanent atrial fibrillation: the Efficacy and safety of dRonedArone for the cOntrol of ventricular rate during atrial fibrillation (ERATO) study. In: Am Heart J., 2008 Sep, 156(3), PMID 18760136.
- DIONYSOS Study Results Showed the Respective Profiles of Dronedarone and Amiodarone. (Memento vom 4. März 2014 im Internet Archive) (PDF).
- Stefan H. Hohnloser, Harry J. G. M. Crijns, Martin van Eickels, Christophe Gaudin, Richard L. Page, Christian Torp-Pedersen, Stuart J. Connolly: Effect of Dronedarone on Cardiovascular Events in Atrial Fibrillation. In: New England Journal of Medicine. Band 360, Nr. 7, 2009, S. 668–678, doi:10.1056/NEJMoa0803778, PMID 19213680 (freier Volltext).
- Stuart J. Connolly, Harry J. G. M. Crijns, Christian Torp-Pedersen, Martin van Eickels, Christophe Gaudin, Richard L. Page, Stefan H. Hohnloser: Analysis of Stroke in ATHENA: A Placebo-Controlled, Double-Blind, Parallel-Arm Trial to Assess the Efficacy of Dronedarone 400 mg BID for the Prevention of Cardiovascular Hospitalization or Death From Any Cause in Patients With Atrial Fibrillation/Atrial Flutter. In: Circulation. Band 120, Nr. 13, 2009, S. 1174–1180, doi:10.1161/CIRCULATIONAHA.109.875252, PMID 19752319 (freier Volltext).
- PALLAS-Studie zu Multaq® (Dronedaron) bei Patienten mit permanentem Vorhofflimmern abgebrochen; Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) vom 18. Juli 2011.
- Review update of Multaq (dronedarone) and increased risk of death and serious cardiovascular adverse events. FDA Drug Safety Communication vom 19. Dezember 2011.