Dibortetrafluorid
Dibortetrafluorid ist eine anorganische chemische Verbindung des Bors aus der Gruppe der Fluoride.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
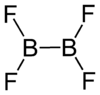 | ||||||||||
| Allgemeines | ||||||||||
| Name | Dibortetrafluorid | |||||||||
| Andere Namen |
Tetrafluorodiboran | |||||||||
| Summenformel | B2F4 | |||||||||
| Kurzbeschreibung |
farbloses Gas[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 97,61 g·mol−1 | |||||||||
| Aggregatzustand |
gasförmig[1] | |||||||||
| Dichte |
3,99 g·l−1[1] | |||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt |
−34 °C[1] | |||||||||
| Löslichkeit |
reagiert mit Wasser[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Gewinnung und Darstellung
Dibortetrafluorid kann durch Reaktion von Fluoridierung von Dibortetrachlorid mit Antimontrifluorid gewonnen werden.[3]
Es entsteht neben anderen Borfluoriden darüber hinaus beim Überleiten von Bortrifluorid über Bor bei 1900–2000 °С.[3]
Es entsteht auch bei der gemeinsamen Kondensation von Bortrifluorid und Kupferatomen. Dazu wird metallisches Kupfer durch elektrische Heizung im Vakuum verdampft und der aus atomarem Kupfer bestehende Dampf zusammen mit Bortrifluorid bei −196 °C kondensiert.[4]
Eigenschaften
Dibortetrafluorid ist ein farbloses brennbares Gas, das mit Wasser reagiert.[1] Es lagert analog Dibortetrachlorid Donatoren zu Addukten B2F6·2D an und zersetzt sich langsam (8 % pro Tag bei Raumtemperatur) in Bortrifluorid und einen braunen Festkörper der Zusammensetzung BF.[3] Im festen Zustand hat Dibortetrafluorid ein planares Molekül mit jeweils etwa 120° Valenzwinkel.[4] Einkristalle der Verbindung enthalten zwei Moleküle in einer monoklinen Elementarzelle mit der Raumgruppe P21/n (Raumgruppen-Nr. 14, Stellung 2) und Parametern von a = 549 pm, b = 653 pm, c = 483 pm und β = 102,5°.[5]
Einzelnachweise
- William M. Haynes: CRC Handbook of Chemistry and Physics, 96th Edition. CRC Press, 2015, ISBN 978-1-4822-6097-7, S. 53 (eingeschränkte Vorschau in der Google-Buchsuche).
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 1033.
- Ralf Steudel: Chemie der Nichtmetalle mit Atombau, Molekülgeometrie und Bindungstheorie. Walter de Gruyter, 1998, ISBN 3-11-012322-3, S. 554 (eingeschränkte Vorschau in der Google-Buchsuche).
- Louis Trefonas, William N. Lipscomb: Crystal and Molecular Structure of Diboron Tetrafluoride, B2F4. In: The Journal of Chemical Physics. 28, 1958, S. 54, doi:10.1063/1.1744079.