Chirales Derivatisierungsreagenz
Chirale Derivatisierungsreagenzien werden in der analytischen Chemie eingesetzt, um Stereoisomere oder Stereoisomerengemische (meist Enantiomerengemische) zu charakterisieren. Dabei wird ein Enantiomerengemisch mit dem enantiomerenreinen chiralen Derivatisierungsreagenz zur Reaktion gebracht. Diese Reaktion liefert Diastereomere, deren Verhältnis leicht analytisch (NMR, HPLC et cetera) bestimmt werden kann. Aus dem Diastereomerenverhältnis kann dann auf das Enantiomerenverhältnis in der zu untersuchenden Probe geschlossen werden. In der NMR-Spektroskopie werden die chiralen Derivatisierungsreagenzien auch chirale Verschiebungsreagenzien genannt.
Geschichte
Seit Einführung der NMR-Spektroskopie in der analytischen Chemie wurden mehrere Methoden zur Anwendung von chiralen Derivatisierungsreagenzien entwickelt. Dabei wird der Unterschied der NMR-Spektren von Diastereomeren quantitativ über die Integrale ausgewählter Resonanzen gemessen.[1] Ein Enantiomerengemisch (Enantiomere haben gleiche NMR-Spektren) wird also mittels eines geeigneten enantiomerenreinen chiralen Derivatisierungsreagenz in Diastereomere umgewandelt, die unterschiedliche NMR-Spektren haben. Harry S. Mosher et al. benutzten 1969 das Carbonsäurechlorid der (R)- oder (S)-α-Methoxy-α-(trifluormethyl)phenylessigsäure, auch bekannt als Mosher-Säure, als chirales Derivatisierungsreagenz für die Untersuchung der Enantiomerenreinheit von Alkoholen und Aminen.[2]
Seither wurden weitere ähnliche Verfahren entwickelt, z. B. unter Verwendung von Phosphor- und Bor-haltigen enantiomerenreinen chiralen Derivatisierungsreagenzien.
α-Methoxy-α-(trifluormethyl)phenylessigsäure
Das Carbonsäurechlorid der enantiomerenreinen (R)- oder (S)-α-Methoxy-α-(trifluormethyl)phenylessigsäure wurde auch benutzt, um die absolute Konfiguration einfacher chiraler Amine oder Alkohole zu ermitteln. Die Abbildung zeigt schematisch die Umsetzung von racemischen Amphetamin mit enantiomerenreiner (R)-Mosher-Säure. Während die Enantiomere (R)- und (S)-Amphetamin identische NMR-Spektren zeigen, unterscheiden sich die Diastereomere (RS) und (RR) im NMR voneinander. Je nach Resonanz sind Shifts von bis zu 47 Hertz möglich.[3]
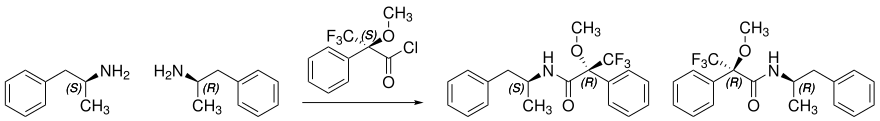
(R)- bzw. (S)-α-Methoxy-α-(trifluormethyl)phenylessigsäure ist ebenso, wie ihre Ester und Amide, unempfindlich gegen Racemisierungsgefahren, da kein α-Wasserstoffatom neben der Carbonylgruppe steht und sich somit kein Enol bilden kann.
Weitere chirale Derivatisierungsreagenzien
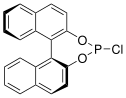
Während viele chirale Derivatisierungsreagenzien fluoriert sind, gibt es auch Ansätze 31P-Spektroskopie zu nutzen, um Enantiomere zu untersuchen. Reiner et al. untersuchten ein auf enantiomerenreinem BINOL basierendes Chlorophosphin. Im 31P-NMR können mit dem Reagenz derivatisierte chirale Alkohole und Amine unterscheiden werden. Die Δδ-Werte liegen bei bis zu 6,7 ppm.[4]
Einen weiteren Ansatz verfolgen Gonçalves et al., die NMR-Spektren von 77Se nutzen, um ee-Werte zu bestimmen. Dazu entwickelten sie eine mix and shake-Methode, um Carbonsäuren direkt im NMR-Röhrchen mit einem enantiomerenreinen α-Selenoalkohol umzusetzen und anschließend zu untersuchen. Dabei kommen DCC und DMAP als Reagenzien zur Estersynthese zum Einsatz. Die Δδ-Werte im 77Se-NMR liegen bei bis zu 211 ppm.[5]

Einzelnachweise
- J. L. Mateos and D. J. Cram: Studies in Stereochemistry. XXXI. Conformation, Configuration and Physical Properties of Open-chain Diastereomers. In: J. Am. Chem. Soc.. 81, Nr. 11, 1959, S. 2756–2762. doi:10.1021/ja01520a037.
- J. A. Dale, D. L. Dull and H. S. Mosher: α-Methoxy-α-trifluoromethylphenylacetic acid, a versatile reagent for the determination of enantiomeric composition of alcohols and amines. In: J. Org. Chem.. 34, Nr. 9, 1969, S. 2543–2549. doi:10.1021/jo01261a013.
- D. Parker: NMR determination of enantiomeric purity. In: Chem. Rev.. 91, Nr. 7, 1991, S. 1441–1457. doi:10.1021/cr00007a009.
- Thomas Reiner, Frederik N. Naraschewski, Jörg Eppinger: 31P NMR assays for rapid determination of enantiomeric excess in catalytic hydrosilylations and transfer hydrogenations. In: Tetrahedron: Asymmetry. Band 20, Nr. 3, Februar 2009, S. 362–367, doi:10.1016/j.tetasy.2009.01.022.
- Jeiely G. Ferreira, Simone M. C. Gonçalves: Enantiomeric excess detection with (S)-3-Phenyl-2-(selenophenyl)propan-1-ol derivatizing agent via mix and shake 77Se NMR. In: Journal of the Brazilian Chemical Society. Band 21, Nr. 11, 2010, S. 2023–2026, doi:10.1590/S0103-50532010001100002.