Magnesiumperoxid
Magnesiumperoxid ist eine chemische Verbindung aus den Elementen Magnesium und Sauerstoff. Es hat die Formel MgO2 und gehört zur Stoffgruppe der Peroxide.
| Kristallstruktur | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
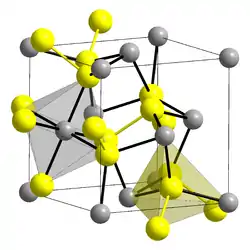 | ||||||||||||||||||||||
| _ Mg2+ _ O22− | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Magnesiumperoxid | |||||||||||||||||||||
| Verhältnisformel | MgO2 | |||||||||||||||||||||
| Kurzbeschreibung |
farb- und geschmackloses Pulver[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 56,30 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Gewinnung und Darstellung
Das Hemihydrat von Magnesiumperoxid kann mit Wasserstoffperoxid aus einer gesättigten Lösung von Magnesiumnitrat gefällt werden. Aus diesem kann durch Erhitzung in Stickstoff das Anhydrat gewonnen werden.[3]
Ebenfalls möglich ist die Gewinnung durch Reaktion von Wasserstoffperoxid mit Magnesiumoxid. Die entstehende kristalline Substanz hat die Zusammensetzung MgO2·0,12 H2O2·0,61 H2O.[3]
Eigenschaften
Magnesiumperoxid ist eine feinpulvrige, farblose Verbindung. Es ähnelt Calciumperoxid und setzt durch kontrollierte Reaktion mit wässrigen Lösungen Sauerstoff frei. Es besitzt eine Kristallstruktur vom Pyrit-Typ und zerfällt oberhalb von 300 °C zu Magnesiumoxid MgO und Sauerstoff.[3]
Verwendung
Magnesiumperoxid wird zur Sauerstofffreisetzung in der kosmetischen, landwirtschaftlichen und pharmazeutischen Industrie genutzt. Es wird auch eingesetzt, um Kontaminationen des Grundwassers zu vermindern und freizuwaschen. Magnesiumperoxid wird außerdem zur natürlichen Dekontamination und Qualitätsverbesserung von landwirtschaftlich genutzten Boden verwendet. Es kann daher auch als Bleich- oder Desinfektionsmittel genutzt werden. Auch in Deodorants und Duschgels kommt es zum Einsatz.
Unter dem Namen Ozovit MP ist es als Medizinprodukt zur Behandlung von Verdauungsstörungen auf dem Markt.
Das erste U-Boot mit Maschinenantrieb, Ictíneo II, erzeugte aus Magnesiumperoxid sowohl Wärme als auch Atemsauerstoff.
Einzelnachweise
- Eintrag zu Magnesiumperoxid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Juli 2014.
- Eintrag zu Magnesiumperoxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Juli 2016. (JavaScript erforderlich)
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 907.

