Brombullvalene
Brombullvalene sind chemische Verbindungen, die sich vom C10H10-Kohlenwasserstoff Bullvalen ableiten und einen oder mehrere Bromsubstituenten aufweisen. Brombullvalene mit bis zu sechs Bromatomen sind bekannt. Wie die Stammverbindung Bullvalen zeigen auch die meisten Brombullvalene das Phänomen der schnellen Valenzisomerisierung. Jedes der zehn Kohlenstoffatome kann jede beliebige Position (Brückenkopf-, Cyclopropyl-Position, sowie olefinische Position benachbart zum Brückenkopfatom, bzw. zum Cyclopropanring) einnehmen und mit jedem anderen Kohlenstoffatom direkt verbunden sein. Der Übergang zwischen den verschiedenen Valenzisomeren erfolgt durch Cope-Umlagerungen.
Darstellung
Durch Bromierung von Bullvalen 1 mit elementarem Brom erhält man durch eine 1,4-Addition das bicyclische Dibromid 2. Die anschließende Dehydrohalogenierung mit einer starken Base, beispielsweise Kaliumhydroxid, Kalium-tert-butanolat, Diazabicyclononen (DBN) oder Diazabicycloundecen (DBU) ergibt das Gemisch mehrerer Monobrombullvale 3. Es handelt sich um eine transannulare 1,4-Eliminierung unter Rückbildung des Bullvalengerüsts.[1]
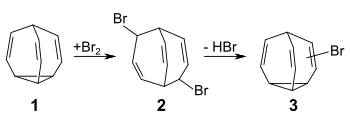
Durch mehrfache Wiederholung dieser Synthesesequenz sind die höhersubstituierten Brombullvalen-Derivate Di-, Tri-, Tetra-, Penta- und Hexabrombullvalen zugänglich.[2][3][4]
Eigenschaften
Brombullvalen
Während es beim unsubstituíerten Bullvalen 1,2 Millionen strukturgleiche Valenzisomere gibt („fluktuierende Struktur“), sind diese bei den monosubstituierten Bullvalenen nicht mehr identisch. Der Substituent kann die Brückenkopfposition B (120 960 Valenzisomere), eine Position am Cylopropanring C (362 880 Valenzisomere) oder eine olefinische Position benachbart zum Brückenkopf OB, bzw. benachbart zum Cyclopropanring OC (jeweils 362 880 Valenzisomere) einnehmen.[5]
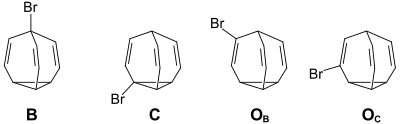
(B: Brückenkopf-Position, C:Cyclopran-Position, OB: olefinische Position Benachbart zum Brückenkopf,
OC: olefinische Position benachbart zum Cyclopropanring)
Die temperaturabhängigen 1H-NMR-Spekten zeigen, dass die beiden olefinischen Positionsisomeren mit einem Anteil von jeweils 50 % im Gleichgewichtsgemisch bevorzugt sind.[6]
Dibrombullvalen
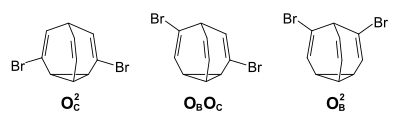
Auch das Dibrombullvalen zeigt das Phänomen der schnellen Valenzisomerisierung. Es sind fünfzehn verschiedene Isomere möglich, neun achirale Positionsisomere, sowie drei Enantiomerenpaare. Im Gleichgewichtsgemisch liegen nur die rein olefinischen Isomere mit den Brom-Substituenten an verschiedenen Ethen-Einheiten vor (OBOC-Enantiomere 59 %,OCOC 27 %, OBOB 14 %).[6]
Tribrombullvalen
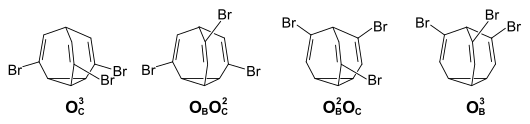
Bei den Bullvalenderivaten mit drei gleichen Substituenten erhöht sich die Zahl der möglichen Isomeren auf 46 – 3 Isomere mit einer C3v-Symmetrie (jeweils 10 080 entartete Valenzisomere), 13 Isomere mit einer C2v-Symmetrie (jeweils 30 240 entartete Valenzisomere), sowie 26 Isomere ohne Symmetrieelement (jeweils 60 480 entartete Valenzisomere für jedes der 13 Enantiomerenpaare). Beim Tribrombullvalen liegen von den 29 verschiedenen möglichen Positionsisomeren im Gleichgewichtsgemisch ausschließlich die rein olefinischen Positionsisomeren mit jeweils einem Substituenten an jeder Ethen-Brücke vor (OBOCOC 48 %, OBOBOC 32 %, OCOCOC 14 %, OBOBOB 6 %)[6]
Tetrabrombullvalen
Mit einem weiteren Bromsubstituenten erhöht sich beim Tetrabrombullvalen die Zahl der möglichen Positionsissomeren auf 47, wobei 25 Positionsisomere kein Symmentrieelement aufweisen und somit als Enantiomerenpaare vorliegen (insgesamt 72 unterscheidbare Isomere). Das 1H-NMR-Spektrum bei −20 °C zeigt, dass im Gleichgewicht neben den drei ausschließlich olefinisch substituierten Positionsisomeren (Enantiomerenpaar OBOBOCOC 49 %, OBOCOCOC 23 %, OBOBOBOC 8 %) auch zu ca. 20 % Positionsisomere mit einem Bromatom am Cycloprpanring und drei olefinischen Bromsubstituenten vorhanden sind.
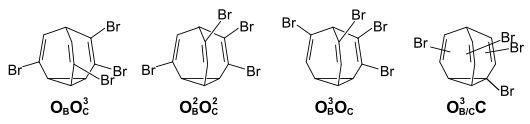
Die Temperaturerhöhung beim 1H-NMR-Spektrum führt wie bei den niedriger substituierten Brombullvalenen zu einer Bandenverbreiterung, jedoch erhält man keine vollständige Mischung der Signale, da sich die Probe bei erhöhter Temperatur zersetzt.
Das 1H-NMR-Spektrum einer frisch aufgelöste Probe von kristallisiertem Tetrabrombullvalen zeigt, dass diese nahezu isomerenrein ist (OBOCOCOC-Isomer). Daraus folgt, dass im Kristall keine Isomerisierungsprozesse stattfinden und die Gleichgewichtseinstellung erst in Lösung stattfindet. Bei 10 °C halbiert sich die Konzentration des Isomers in einer Stunde. Chromatographisch lässt sich aus dem Gleichgewichtsgemisch von Tetrabrombullvalen das OBOBOBOC isolieren. Die Gleichgewichtseinstellung ausgehend von diesem Isomer erfolgt deutlich langsamer. Bei 40 °C halbiert sich die Konzentration in 90 Minuten.[3]
Pentabrombullvalen
Die maximale Anzahl an möglichen Positionsisomeren erreicht man bei Pentabrombullvalen. Es sind 84 verschiedene Isomere (24 Positionsisomere mit C2v-Symmetrie und 30 Enationmerenpaare), von denen im Gleichsgewichsgemisch die zwei Positionsisomeren mit ausschließlich olefinischer Substitution (54 % und 24 %), sowie zwei Positionsisomere mit einem Cyclopopyl- und drei olefinischen Substituenten (13 % und 9 %) vorliegen.
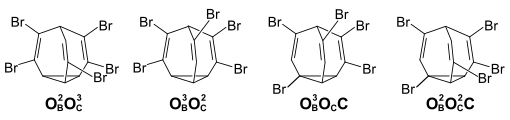
Das Isomer mit drei OB und zwei OC-Substituenten (24 % im Gleichgewichtsgemisch) kann chromatographisch isoliert werden. Es ist ein kinetisch sehr stabiles Isomer, das auch nach mehreren Tagen in Lösung bei Raumtemperatur nicht isomerisiert. Die Halbwertszeit der Gleichgewichtseinstellung bei 55 °C beträgt ca. 30 Stunden.[4]
Hexabrombullvalen
Die Zahl der möglichen Isomeren von Hexabrombullvalen entspricht der von Tetrabrombullvalen. Es lassen sich zwei Positionsisomere isolieren – das rein olefinisch substituierte Isomer, sowie das Isomer mit einer doppelt substituierten Ethen-Einheit und einer OBC-Substitution an der dritten Brücke.
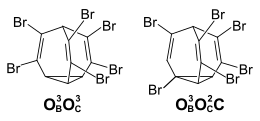
Auch nach mehreren Tagen bei 60 °C zeigt das 1H-NMR-Spektrum des Isomers mit dem Cyclopropylsubstituenten keine Anteile an dem rein olefinisch substituierten Isomer, während dieses nach 10 Tagen sich zu etwa 10 % in das andere Isomer umgewandelt hat. Beim Hexabrombullvalen ist somit die bullvalentypische Eigenschaft der fluktuierenden Struktur weitgehend verlorengegangen.[4]
Verwendung
Ausgehend von den Brombullvalenen können mit Halogenaustausch-Reaktionen Bullvalen-Derivate mit anderen Substituenten hergestellt werden. Es sind unter anderem Bullvalen-Derivate mit Methyl-, Phenyl-, Fluor- und Hydroxymethyl-Substituenten bekannt, wobei bei mehreren Substituenten diese identisch oder unterschiedlich sein können.[7]
Über das Dihydroxymethylbullvalen sind durch Umsetzung mit Polyethylenglycol-ditosylaten unter basischen Bedingungen verschiedenen Kronenether zugänglich, die die Bullvalen-typische Temperaturabhängigkeit der 1H-NMR-Spektren zeigen. Durch die unterschiedlichen möglichen Positionsisomeren ist die Ringgröße der Kronenether variabel. Für diese Substanzklasse wurde der Begriff der „atmenden“ Kronenether geprägt.[8]
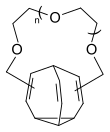
n=1: Bullvaleno[11-13]krone-3 n=2: Bullvaleno[14-16]krone-4
n=3: Bullvaleno[17-19]krone-5 n=4: Bullvaleno[20-22]krone-6
n=5: Bullvaleno[23-25]krone-7
Einzelnachweise
- G. Schröder, R. Merényi, J.F.M. Oth: Moleküle mit schneller und reversibler Valenzisomerisierung.II. In: Tetrahedron Letters. Band 5, Nr. 14, Januar 1964, S. 773–777, doi:10.1016/0040-4039(64)83034-3.
- J.F.M. Oth, R. Merényi, G. Engel Und G. Schröder: Synthese und NMR-spektroskopisches Verhalten zweier disubstituierter Bullvalene. In: Tetrahedron Letters. Band 7, Nr. 29, Januar 1966, S. 3377–3382, doi:10.1016/s0040-4039(01)82797-0.
- Bernhard Volkmann, Gerhard Schröder: Isolierbare Positionsisomere des Tetrabrombullvalens. In: Chemische Berichte. Band 117, Nr. 6, Juni 1984, S. 2226–2232, doi:10.1002/cber.19841170615.
- Karl Rebsamen, Gerhard Schröder: Penta- und Hexabrombullvalene. In: Chemische Berichte. Band 126, Nr. 6, Juni 1993, S. 1425–1427, doi:10.1002/cber.19931260623.
- Jean F. M. Oth, Robert Merényi, Jan Nielsen, Gerhard Schröder: Moleküle mit schneller und reversibler Valenzisomerisierung, VI. Synthesen und Eigenschaften einiger monosubstituierter Bullvalene. In: Chemische Berichte. Band 98, Nr. 10, Oktober 1965, S. 3385–3400, doi:10.1002/cber.19650981040.
- Karl Rebsamen: Methyl- und Phenylbullvalene. Dissertation, Universität Karlsruhe (TH). Karlsruhe 1986.
- Keshab Sarma, Walter Witt, Gerhard Schröder: Zur Frage der Stellungsisomerie bei disubstituierten Bullvalenen. In: Chemische Berichte. Band 119, Nr. 7, Juli 1986, S. 2339–2349, doi:10.1002/cber.19861190724.
- Keshab Sarma, Walter Witt, Gerhard Schröder: Bullvaleno-kronenether – Kronenether mit variablen Ringgrößen. In: Chemische Berichte. Band 116, Nr. 12, Dezember 1983, S. 3800–3812, doi:10.1002/cber.19831161205.