Biuret
Biuret [biuˈreːt] ist eine organische Verbindung aus der Gruppe der Carbonsäureamide, die sich von der instabilen Allophansäure (Carbamoylcarbamidsäure H2N–CO–NH–COOH) ableitet. Biuret entsteht bei der Pyrolyse von Harnstoff durch Kondensation von zwei Molekülen Harnstoff unter Abspaltung von einem Molekül Ammoniak.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
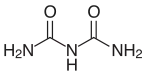 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Biuret | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C2H5N3O2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose, hygroskopische Kristalle[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 103,09 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,47 g·cm−3 [2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Darstellung
Biuret wird im Labormaßstab durch Erhitzen von Harnstoff unter Abspaltung von Ammoniak hergestellt:
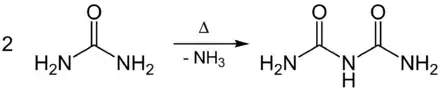
Neben Biuret entstehen auch geringe Mengen an Triuret und Melamin.
Eigenschaften und Nachweis
Biuret ist eine farblose, kristalline, wasseranziehende Substanz, die sich wenig in kaltem Wasser oder Ether, gut in heißem Wasser löst (aufgrund schwach ampholyter Eigenschaften im Sauren und Basischen besser als im Neutralen). Biuret geht beim Erhitzen teilweise in Melamin über. Bei der Zersetzung von Biuret ab 188 °C können neben Cyanursäure und Ammoniak auch noch Stickstoffoxide sowie Kohlenstoffmonoxid und Kohlenstoffdioxid entstehen. Auf Pflanzen wirkt Biuret toxisch; schon geringe Mengen (50–150 ppm in der Nährlösung) bewirken eine Chlorose.[4]
Biuret bildet mit einigen Metallen im alkalischen Medium farbige Koordinationsverbindungen. Mit Kupfer(II)-Ionen bildet sich ein rot-violetter Komplex und mit Nickel(II)-Ionen ein gelb-orangener.
Bei der sogenannten Biuretreaktion mit Proteinen ist ebenfalls ein rot-violetter Farbton zu beobachten. Hier fungieren statt Biuret die Peptidgruppen als Liganden für das Kupferion. Diese Reaktion kann für den Nachweis von Proteinen in wässrigen Lösungen verwendet werden. So kann in der klinischen Diagnostik mittels der Biuretmethode nach Weichselbaum das Gesamtprotein in Körperhöhlenergüssen (Transsudaten und Exsudaten) bestimmt werden.
Verwendung
Es ist keine industrielle Verwendung von Biuret bekannt.
Biuret ist als Verunreinigung in jedem industriell hergestellten Harnstoff vorhanden. Bei der Verwendung von Harnstoff als Düngemittel ist der Gehalt an Biuret allerdings begrenzt (meist kleiner 1 %), da sich dieses hemmend auf das gesunde Pflanzenwachstum auswirkt.[4]
Einzelnachweise
- Eintrag zu Biuret. In: Römpp Online. Georg Thieme Verlag, abgerufen am 30. September 2014.
- Eintrag zu Biuret in der GESTIS-Stoffdatenbank des IFA, abgerufen am 16. Juni 2020. (JavaScript erforderlich)
- Europäisches Arzneibuch, Deutscher Apotheker Verlag Stuttgart, 6. Ausgabe, 2008, S. 543, ISBN 978-3-7692-3962-1.
- Haas, A. R. C., Brusca, J. N.: Biuret, Toxic Form of Nitrogen, California Agriculture, 1954 8(6):7, 11.