Calciumchlorat
Calciumchlorat ist eine chemische Verbindung aus der Gruppe der Chlorate.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
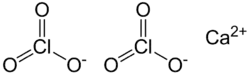 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Calciumchlorat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | Ca(ClO3)2 | |||||||||||||||
| Kurzbeschreibung |
farbloser bis gelblicher geruchloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 206,98 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
2,711 g·cm−3 (Dihydrat)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
Zersetzung[1] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Calciumchlorat kann durch Reaktion von Chlor in eine heiße Aufschlämmung von Calciumhydroxid gewonnen werden.[4]
Eine elektrochemische Herstellung aus Calciumchlorid ist ebenfalls möglich.
Eigenschaften
Calciumchlorat ist ein hygroskopischer, geruchloser, farbloser bis gelblicher Feststoff mit monokliner Kristallstruktur, welcher sehr leicht löslich in Wasser ist. Er zersetzt sich ab einer Temperatur über 100 °C, wobei unter anderem Sauerstoff entsteht.[1] Das Dihydrat verliert sein Kristallwasser bei Temperaturen größer als 100 °C.[5]
Verwendung
Calciumchlorat wird zur Herstellung von Feuerwerk, Herbiziden und in der Analogfotografie verwendet.[5]
Sicherheitshinweise
Calciumchlorat ist ein reaktionsfähiger brandfördernder Feststoff. Er brennt selbst nicht, reagiert aber so heftig mit brennbaren Stoffen, dass er diese zum Teil ohne weitere Zündquelle zur Entzündung bringen und einen bestehenden Brand erheblich fördern kann. Beim Mischen mit brennbaren Stoffen besteht Explosionsgefahr.[1]
Einzelnachweise
- Eintrag zu Calciumchlorat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. Springer, 1998, ISBN 978-3-540-60035-0, S. 348 (eingeschränkte Vorschau in der Google-Buchsuche).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. CRC Press, 2009, ISBN 978-1-4200-9084-0.
- Karl-Heinz Lautenschläger, Werner Schröter, Andrea Wanninger: Taschenbuch der Chemie. 2005, ISBN 978-3-8171-1760-4 (Seite 593 in der Google-Buchsuche).
- Richard P. Pohanish: Sittig's Handbook of Toxic and Hazardous Chemicals and Carcinogens. 2011, ISBN 978-1-4377-7869-4 (Seite 525 in der Google-Buchsuche).
