Bariumborat
Bariumborat (genauer Bariummetaborat) ist eine chemische Verbindung des Bariums aus der Gruppe der Borate. Sie kommt in verschiedenen Modifikationen vor, die sich durch ungewöhnliche Eigenschaften wie optische Doppelbrechung und optische Nichtlinearität[5] auszeichnen.
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
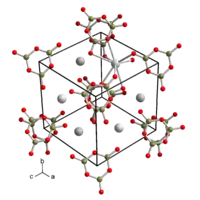 | |||||||||||||||||||
| Kristallstruktur von β-Bariumborat _ Ba2+ _ B3+ _ O2− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Bariumborat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Verhältnisformel | Ba(BO2)2 | ||||||||||||||||||
| Kurzbeschreibung |
weißer geruchloser Feststoff (Monohydrat)[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 222,95 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Brechungsindex |
1,55–1,60 (Monohydrat)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Gewinnung und Darstellung
Bariumborat kann durch Reaktion einer Borsäurelösung mit Bariumhydroxid gewonnen werden. Das entstehende γ-Bariumborat enthält Kristallwasser, das durch Erhitzen auf 300–400 °C entfernt werden kann. Bei Erhitzung auf 600 bis 800 °C setzt sich dieses vollständig zu β-Bariumborat um.[2] Bariumborat-Monohydrat wird aus einer Lösung von Bariumsulfid und Natriumtetraborat hergestellt. Das Dihydrat entsteht durch Ausfällung aus einer Bariumchloridlösung durch Zugabe einer Natriummetaboratlösung bei 90 bis 95 °C. Bei Raumtemperatur fällt das Tetrahydrat aus.[6]
Eigenschaften

Farben: grün – Barium, pink – Bor, rot – Sauerstoff

Bariumborat-Monohydrat ist ein weißer Feststoff, der wenig wasserlöslich ist. Das ebenfalls weiße[7] Dihydrat verliert bei 140 °C Kristallwasser.[6] Die Hochtemperaturform α-Bariumborat[8] hat gute mechanische Eigenschaften (Mohs-Härte von 4,5), eine hohe Doppelbrechung und ist in einem sehr weiten Bereich zwischen 189 und 3500 nm durchsichtig.[2] Sie kristallisiert trigonal, Raumgruppe R3c (Raumgruppen-Nr. 167) mit den Gitterparametern a = 7,235 Å und c = 39,19 Å.[9] Ähnlich wie die α-Form besitzt die Niedertemperaturform β-Bariumborat (BBO) eine trigonale Kristallstruktur mit der Raumgruppe R3c (Nr. 161)[5] und den Gitterparametern a = 8,380 Å und α = 96,65°.[10] Die Struktur enthält nahezu planare trimere Ionen (BO2)3−. Jedes Bariumatom wird von acht Sauerstoffatomen benachbarter Anionen koordiniert.[10] Die Tieftemperaturphase weist nichtlineare optische Eigenschaften auf. Im Vergleich zu Kaliumdihydrogenphosphat (KDP) hat die Verbindung eine nahezu sechsmal so hohe Nichtlinearität und einen weiten Bereich von Wellenlängen (ca. 210 bis 2100 nm), in dem der Kristall transparent ist. Ähnlich wie KDP kann BBO auch bei Laserpulsen sehr hoher Energiedichte eingesetzt werden (hohe Zerstörschwelle: ca. 5 GW/cm2 bei 1064 nm Wellenlänge und 10 ns Impulsdauer).
Die Brechungsindices no und ne von BBO werden durch die Sellmeier-Gleichung
beschrieben. In Veröffentlichungen werden unterschiedliche Werte für die experimentell ermittelten Sellmeier-Koeffizienten (A, B, C, D) angegeben. Beispielhaft die Werte von Kato:[11]
A B/µm2 C/µm2 D/µm−2 no 2,7359 0,01878 −0,01822 −0,01354 ne 2,3753 0,01224 −0,01667 −0,01516
Verwendung
Bariumborat-Monohydrat wird als Pigment, Korrosionshemmer (durch seine alkalischen Eigenschaften[12]), Flammschutzmittel, Tannin-Verfärbungsblockierungsmittel für Lacke und weiteres verwendet.[13] Das Dihydrat wird als Flammschutzmittel in Farben, Papier, Textilien und Plastik verwendet.[6] Bariumborat ist seit den 1960er-Jahren in den USA als Bakterizid und Fungizid zugelassen. α-Bariumborat ist ein nützliches Material für Hochleistungs-UV-Licht-Polarisationsoptiken[2] und Akustooptiken.[14] β-Bariumborat wird verwendet für:
- Frequenzverdopplung und Mischen (Erzeugung der Summen- und Differenzfrequenz) des Lichtes von (gepulsten) Lasern
- Korrelation zur Messung der Impulsdauer und -form ultrakurzer Laserpulse
- optisch parametrische Oszillatoren
- Pockels-Zellen
- zur Erzeugung von UV-Licht[15]
Verwandte Verbindungen
- Bariumorthoborat Ba3(BO3)2
Einzelnachweise
- Datenblatt Barium metaborate monohydrate bei AlfaAesar, abgerufen am 8. Juni 2014 (PDF) (JavaScript erforderlich).
- Richard C. Ropp: Encyclopedia of the Alkaline Earth Compounds. Newnes, 2012, S. 511 (eingeschränkte Vorschau in der Google-Buchsuche).
- W. Paulus: Microbicides for the Protection of Materials: A Handbook. Springer, 1993, S. 429 (eingeschränkte Vorschau in der Google-Buchsuche).
- Eintrag zu Bariummetaborat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Juli 2016. (JavaScript erforderlich)
- Govindhan Dhanaraj, Kullaiah Byrappa, Vishwanath Prasad, Michael Dudley: Springer Handbook of Crystal Growth. Springer, 2010, S. 729 ff. (eingeschränkte Vorschau in der Google-Buchsuche).
- Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. CRC Press, 2011, S. 498 (eingeschränkte Vorschau in der Google-Buchsuche).
- William M. Haynes: CRC Handbook of Chemistry and Physics, 93rd Edition. CRC Press, 2012, S. 50 (eingeschränkte Vorschau in der Google-Buchsuche).
- Die Bezeichnung der Tief- und Hochtemperaturform als β- und α-Form wird in der Literatur uneinheitlich gehandhabt. In der neueren Literatur hat sich die Bezeichnung α-Form für die Hochtemperaturform etabliert.
- A. Perloff, S. Block, A.D. Mighell: The crystal structure of the high temperature form of barium borate. In: Acta Crystallographica, 20, 1966, S. 819–823, doi:10.1107/S0365110X66001920.
- R. Fröhlich: Crystal structure of the low-temperature form of BaB2O4. In: Zeitschrift für Kristallographie, 168, 1984, S. 109–112, doi:10.1524/zkri.1984.168.14.109.
- K. Kato: „Second-Harmonic Generation to 2048 Å in β-BaB2O4“, IEEE Journal of Quantum Electronics, 1986, 22 (7), S. 1013–1014, doi:10.1109/JQE.1986.1073097.
- Amy Forsgren: Corrosion Control Through Organic Coatings. CRC Press, 2006, S. 42 (eingeschränkte Vorschau in der Google-Buchsuche).
- Michael Ash, Irene Ash: Handbook of Green Chemicals. Synapse Info Resources, 2004, S. 132 (eingeschränkte Vorschau in der Google-Buchsuche).
- I. Martynyuk-Lototska: Highly efficient acoustooptic diffraction in alpha-BaB2O4 crystals: improving of geometry of acoustooptic interaction. In: Ukrainian Journal of Physical Optics. 13, 2012, S. 28, doi:10.3116/16091833/13/1/28/2012.
- Mark Peltz: Charakterisierung von neuen nichtlinearen Kristallen zur Frequenzkonversion … Tenea Verlag Ltd., 2004, S. 148 (eingeschränkte Vorschau in der Google-Buchsuche).

