ELISpot
Der ELISpot Assay (Enzyme Linked Immuno Spot Assay) dient zum Nachweis sezernierter Zytokine oder Antikörper, die von einzelnen Immunzellen nach Stimulation mit Antigenen sezerniert und an einer Membran immobilisiert werden.[1]
Stimulation
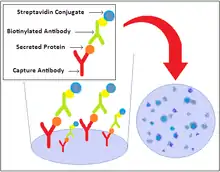
Die selektive Bindung der sezernierten Proteine erfolgt analog zum ELISA, jedoch mit auf einer undurchsichtigen Membran (meistens aus PVDF) immobilisierten Antikörpern (engl. coating antibody oder auch capture antibody). Nach der Beschichtung der Membranen im Mikrotiterplattenformat mit dem Erstantikörper werden die verbliebenen unspezifischen Proteinbindungsstellen der Membranen mit sterilen FCS- oder BSA-Lösungen blockiert. Die beschichteten Platten werden im Anschluss mit den sezernierenden Zellen und einem zu untersuchenden Stimulus (z. B. ein Antigen oder ein daraus abgeleitetes Peptid) versehen. Die sezernierten Zytokine oder Antikörper binden an den immobilisierten Erstantikörper. Nach einer erschütterungsfreien Inkubationsdauer, üblicherweise zwischen 16 Stunden und 48 Stunden, werden die Zellen entfernt und die Detektion kann unter unsterilen Bedingungen erfolgen. Bei Erschütterungen kommt es bei nicht-adhärenten Zellen (synonym: Suspensionszellen) zu Lateralbewegungen und zu einer fälschlicherweise erhöhten Anzahl an Spots.
Detektion
Nach der Inkubationsdauer werden die Zellen entfernt und eine Immunfärbung der sezernierten Zytokine oder Antikörper durchgeführt. Die Detektion erfolgt über die selektive Bindung eines zweiten, meistens biotinylierten Antikörpers gegen ein anderes Epitop des nachzuweisenden Zytokins, meistens gefolgt von der Bindung eines Streptavidins mit gekoppeltem Reporterenzym und dem Ausfallen eines Farbstoffs an der Sekretionsstelle. Zur Messung der Reaktion von zytotoxischen T-Zellen wird als Zytokin oftmals Interferon-γ gemessen. Durch ein Farbstoffsubstrat umsetzendes Enzym, welches an den zweiten Antikörper oder an einen weiteren Signalamplifikator (z. B. biotinylierte Detektionsantikörper und Avidin-Konjugate oder Detektionsantikörper und polyklonale anti-Fc-Antikörper-Konjugate) gekoppelt ist, fällt der Farbstoff an der Sekretionsstelle aus. Dies erlaubt je nach Farbstoff eine Darstellung der Zytokine als kleine rote (Naphthol-AS-MX-Phosphat/Fast Red TR oder H2O2/AEC), braune (mit H2O2 und DAB oder TMB) oder blaue Punkte (mit NBT/BCIP), mit einem Durchmesser von 75 bis 400 µm sichtbar zu machen. Durch Vergleich mit den entsprechenden Negativkontrollen (mit einem irrelevanten Antigen oder Peptid) kann eine Reaktion nachgewiesen werden. Eine Positivkontrolle mit einem Mitogen wie Pokeweed Mitogen (PWM) oder Phorbol-12-myristat-13-acetat (PMA) zeigt die erfolgreiche Durchführung des ELISpots an, beispielsweise ob die verwendeten Zellen noch lebend waren. Das Mitogen erzeugt eine Antigen-unabhängige Aktivierung der Zellen und eine folgende Sekretion des gesuchten Immunbotenstoffs. Die automatische Auszählung mittels Kamera und Software bestimmt bei den gefärbten und getrockneten Platten, wie viele der eingesetzten Zellen in jedem Ansatz reagierten und mit welcher Intensität (Spotfläche, Spot-Farbsättigung) sie reagierten.
Diese Methode findet unter anderem in der Diagnostik von Autoimmunerkrankungen, Transplantationsrisiken, Allergien und Infektionskrankheiten oder auch in der Impfstoffentwicklung Anwendung. Bei T-Zellen und B-Zellen werden ELISpots zur Messung von Zytokinreaktionen nach Peptidstimulation durchgeführt, um immunogene T- und B-Zell-Epitope zu identifizieren (engl. epitope mapping für ‚Epitopkartierung‘). Durch ELISPOT identifizierte Epitope sind z. B. in der IEDB registriert.
Einzelnachweise
- Czerkinsky C, Nilsson L, Nygren H, Ouchterlony O, Tarkowski A: A solid-phase enzyme-linked immunospot (ELISPOT) assay for enumeration of specific antibody-secreting cells. In: J Immunol Methods. 65, Nr. 1–2, 1983, S. 109–121. doi:10.1016/0022-1759(83)90308-3. PMID 6361139.