Aminoglykosid-Antibiotika
Aminoglykosid-Antibiotika, kurz Aminoglykoside, sind den Kohlenhydraten verwandte Oligomere und bestehen aus Aminozucker- und stickstoffhaltigen Cyclitol-Bausteinen. Sie bilden eine große, anwachsende Gruppe von ca. 200 wasserlöslichen antibiotisch wirksamen Substanzen, von denen viele arzneilich verwendet werden.
Streptomycin war das erste Aminoglykosid-Antibiotikum, das bereits 1944 durch die Gruppe um Selman Waksman entdeckt wurde. Nachfolgend wurden viele ähnliche Wirkstoffe aus Actinomyceten, vor allem der Gattungen Streptomyces und Micromonospora isoliert.
Konventionsgemäß werden die Aminoglykosid-Antibiotika aus der Gattung Streptomyces mit dem Suffix -mycin bezeichnet, während diejenigen aus der Gattung Micromonospora mit dem Suffix -micin benannt werden.
Wirkmechanismus
Die Aminoglykosid-Antibiotika wirken ausgeprägt konzentrationsabhängig[1] stark bakterizid durch Hemmung der Proteinbiosynthese bei sich teilenden und nicht-teilenden Erregern, indem sie an die 30S-Untereinheit der Ribosomen ankoppeln[2] und Ablesefehler der mRNA verursachen. Dadurch werden fehlerhafte Proteine gebildet, die ihre biologische Funktion verlieren. In der Konsequenz werden z. B. defekte Proteine in die Zellmembran des Bakteriums eingebaut, was zur Lyse des Erregers führt.
Einteilung und wichtige Vertreter
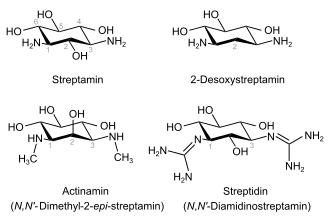
Aminoglycoside weisen als zentrales Strukturelement ein Amino-Cyclitol auf – abgeleitet z. B. vom Streptamin (1,3-Diamino-1,3-didesoxy-scyllo-inositol), das glycosidisch mit einem oder zwei Aminozuckern verbunden ist. Zusätzlich können stickstofffreie Monosaccharidkomponenten enthalten sein. Therapeutisch verwendete Aminoglycoside lassen sich in folgende Hauptgruppen einteilen:
- vom Streptidin abgeleitet: Streptomycine
- vom 2-Desoxystreptamin abgeleitet: die 4,6-disubstituierten Vertreter der Kanamycin/Gentamicin-Gruppe und ihre Abkömmlinge, die 4,5-disubstituierten Neomycine, und einfach substituierte Vertreter wie etwa das tiermedizinisch eingesetzte Apramycin und Hygromycin B.
Spectinomycin ist wegen des fehlenden Aminozuckers kein echtes Aminoglycosid, wird jedoch den Aminoglycosiden zugerechnet. Sein Aglycon ist das N,N′-Dimethyl-2-epi-streptamin (Actinamin). Eine weitere Besonderheit ist die halbacetalische Struktur.
Streptidin-Gruppe
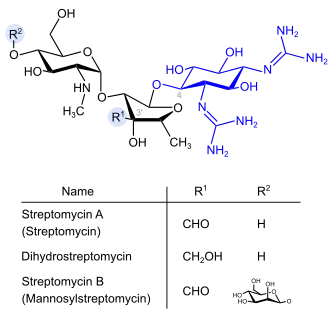 Strepotomycine (blau: Streptidinstruktur)
Strepotomycine (blau: Streptidinstruktur)
Desoxystreptamin-Gruppe
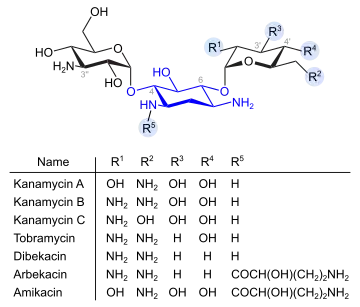 Kanamycine und verwandte Verbindungen (blau: Desoxystreptaminstruktur)
Kanamycine und verwandte Verbindungen (blau: Desoxystreptaminstruktur)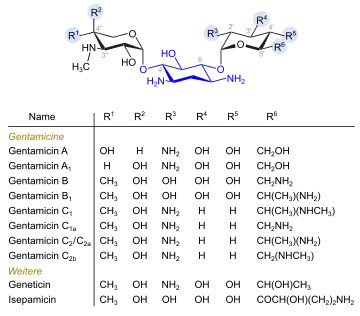 Gentamicine und verwandte Verbindungen (blau: Desoxystreptaminstruktur)
Gentamicine und verwandte Verbindungen (blau: Desoxystreptaminstruktur)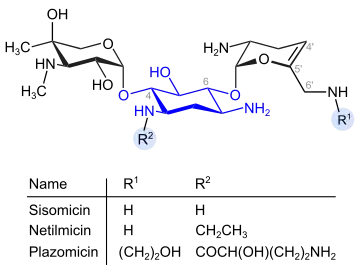 Dehydro-Analoga von Gentamicin (blau: Desoxystreptaminstruktur)
Dehydro-Analoga von Gentamicin (blau: Desoxystreptaminstruktur)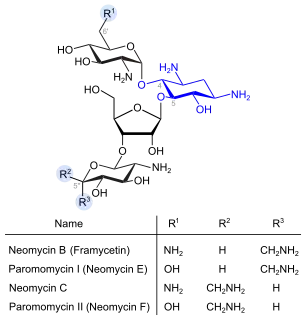 Neomycine (blau: Desoxystreptaminstruktur)
Neomycine (blau: Desoxystreptaminstruktur)
Ein weiterer Vertreter der Desoxystreptamin-Gruppe ist Verdamycin, ein in Position 6‘ methyliertes Sisomicin (6‘-Methylsisomicin).
Isepamicin, Plazomicin, Arbekacin und Amikacin sind Vertreter einer Generation halbsynthetischer Aminoglycoside aus den 1970er Jahren, die durch Einführung einer (S)-4-Amino-2-hydroxybuttersäure-Seitenkette die entsprechende Aminogruppe vor enzymatischem Deaktivierung durch die Erreger bewahren.[3]
Galerie
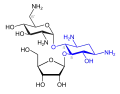 Ribostamycin
Ribostamycin
(blau: Desoxystreptamin-Struktur) Apramycin
Apramycin
(blau: Desoxystreptamin-Struktur) Hygromycin B
Hygromycin B
(blau: Desoxystreptamin-Struktur)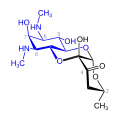 Spectinomycin
Spectinomycin
(blau: Actinamin-Struktur)
Anwendung und Darreichung
Das Wirkspektrum umfasst vor allem die gramnegativen Enterobakterien und Pseudomonas aeruginosa sowie die grampositiven Staphylokokken. Aminoglykoside sind gegen anaerobe Bakterien wirkungslos, da sie durch einen Sauerstoff verbrauchenden Prozess in die Zelle aufgenommen werden. Ebenso wenig wirken sie gegen Streptokokken und Haemophilus-Arten.[4]
Sie werden beispielsweise bei schwerwiegenden Infektionen wie Hirnhautentzündung (Meningitis) und Herzinnenhautentzündung (Endokarditis) eingesetzt, sowie auch häufig gegen Lungeninfektionen (Pseudomonas aeruginosa, siehe oben) im Rahmen einer bestehenden Cystischen Fibrose.
Aminoglykoside werden nicht resorbiert und müssen bei systemischen Infektionen daher parenteral verabreicht werden. Sie erreichen eine gute Verteilung im Extrazellulärraum und sind plazentagängig, sie passieren allerdings die Zellwände des Wirtsorganismus kaum und sind somit schlecht gewebegängig, bei einer bestehenden Hirnhautentzündung sind sie mäßig liquorgängig. Die Ausscheidung erfolgt mit einer kurzen Halbwertszeit von etwa zwei Stunden vorwiegend über die Nieren.
Problematisch ist die rasche Resistenzentwicklung, die unter einer Aminoglykosidtherapie auftreten kann. Sie werden daher in der Regel in Kombination mit anderen Antibiotika (v. a. β-Lactam-Antibiotika) gegeben.
Wegen der toxischen Nebenwirkungen (s. u.) sind die Serumspiegel von Aminoglykosiden während der antibiotischen Therapie zu überwachen, wobei für die toxischen Nebenwirkung vor allem die Talspiegel und für die antibakterielle Aktitivität die Spitzenspiegel bedeutsam sind.[1] Beispiele für Richtwerte von Aminoglykosidspiegeln (hier im 8-Stunden-Intervall):
- Amikacin: Spitzenspiegel 20–30 mg/L, Talspiegel 5–10 mg/L
- Gentamicin, Tobramycin und Netilmicin: 6–10; unter 2.
Nebenwirkungen
Wegen ihrer geringen therapeutischen Breite müssen systemische Aminoglykoside sehr sorgfältig dosiert werden und sind daher typisch intensivmedizinische Antibiotika. Aminoglykoside reichern sich in Niere und Innenohr besonders an und wirken dort stark giftig (Nephrotoxizität, Ototoxizität).[4] Man geht davon aus, dass die Ototoxizität der Aminoglykoside über mehrere Mechanismen zustande kommt. Aminoglykoside gelangen über einen spezifischen Transduktionskanal auf den Zilien der Haarzellen im Innenohr in das Zellinnere. Aufgrund elektrischer Ladungen an der dem Zellinneren zugewandten Seite des Kanals können sie die Zellen auf diesem Weg nicht mehr verlassen und reichern sich an. Im Zellinnern können die Aminoglykoside mit Metallionen Chelatkomplexe bilden, welche die Bildung von reaktiven Sauerstoffspezies (ROS) katalysieren, die oxidative Schäden an verschiedenen Zellstrukturen verursachen und letztlich den Zelluntergang bewirken. Es entstehen irreversible Schäden, die von leichtem Hörverlust in den oberen Frequenzbereichen bis zur vollständigen Taubheit reichen können. Weitere Mechanismen, die auf Wechselwirkungen der Aminoglykoside mit verschiedenen Ionenkanälen und Rezeptoren beruhen, sind noch nicht im Detail geklärt.[5]
Weitere mögliche Nebenwirkungen sind Atemlähmung, Allergien oder Blutbildungsstörungen. Bei einmaliger täglicher Gabe ist das Verhältnis von erwünschter zu unerwünschter Wirkung besonders günstig. Dies hängt damit zusammen, dass es sich bei den Aminoglykosiden um konzentrationsabhängige Antibiotika handelt, welche gut wirken, wenn die Spitzenspiegel weit über der minimalen Hemmkonzentration des Erregers liegen, die Talspiegel aber sehr niedrig sind (< 1μg/ml). Die Nebenwirkungen hingegen verstärken sich wenn hohe Talspiegel zustande kommen, wie es bei häufigerer Gabe der Fall wäre. Das liegt daran, dass sich in den vor allem betroffenen Organen Niere und Innenohr der Wirkstoff anreichert und nur dann wieder ins Blut abgegeben wird, wenn die peripheren Spiegel niedrig sind, ist das nicht der Fall, weil die Talspiegel hoch sind, so bleibt der Wirkstoff in den Organen und schädigt sie. Daher ist es wichtig vor einer weiteren Gabe eine Talspiegelbestimmung durchzuführen.
Eine Einmaldosierung von Aminoglykosiden ist von Ausnahmefällen abgesehen nicht zugelassen bei Kindern und Schwangeren, Endokarditis, Meningitis, schwerster Sepsis, ausgeprägtem Aszites, schweren Verbrennungen, Dialyse oder Hämofiltration.[1]
Einige Aminoglykoside (Neomycin, Kanamycin) sind wegen ihrer Nephro- und Ototoxizität ausschließlich zur Behandlung lokaler Infektionen (Haut, Schleimhaut, Auge) angezeigt.[4]
Einzelnachweise
- Marianne Abele-Horn: Antimikrobielle Therapie. Entscheidungshilfen zur Behandlung und Prophylaxe von Infektionskrankheiten. Unter Mitarbeit von Werner Heinz, Hartwig Klinker, Johann Schurz und August Stich, 2., überarbeitete und erweiterte Auflage. Peter Wiehl, Marburg 2009, ISBN 978-3-927219-14-4, S. 334.
- Eintrag zu Aminoglykosid-Antibiotika. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Juni 2014.
- D. Obrecht, F. Bernardini, G. Dale, K. Dembowsky: Emerging New Therapeutics Against Key Gram-Negative Pathogens. In: Annual Reports in Medicinal Chemistry, Band 46, 2011, S. 245-262.
- Ernst Mutschler: Arzneimittelwirkungen. 9. Auflage, Wissenschaftliche Verlagsgesellschaft, Stuttgart 2008, ISBN 978-3-8047-1952-1.
- F. Maurer: Gefahr für Ohr und Gleichgewicht. In: Pharmazeutische Zeitung. Ausgabe 22/2016 (pharmazeutische-zeitung.de).