Kumulene
Kumulene, oft auch Cumulene, (von lat.: cumulare ‚anhäufen‘, Betonung auf der dritten Silbe: Kumulene) sind eine Stoffgruppe organisch-chemischer Verbindungen, bei denen Doppelbindungen unmittelbar aneinandergereiht sind, die also ein System von kumulierten Doppelbindungen[1] enthalten.
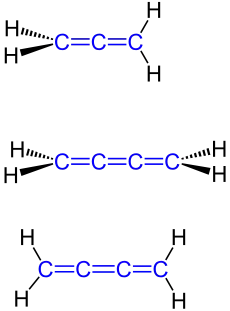
Ob innerhalb einer Verbindung schon zwei kumulierte Doppelbindungen wie bei den Allenen ausreichen, um zur Stoffgruppe der Kumulene hinzugerechnet zu werden, wird in der Fachliteratur kontrovers diskutiert. Der Römpp[2] bejaht dies, das Gold Book[3] dagegen definiert die Kumulene als Verbindungen mit einer Abfolge von mindestens drei kumulierten Doppelbindungen und schließt damit die Allene von den Kumulenen aus.
In Abhängigkeit von diesen unterschiedlichen Definitionen sind die einfachsten Vertreter der Kumulene das Propadien („Allen“, H2C=C=CH2) bzw. das Butatrien (H2C=C=C=CH2).
Verbindungen, die an einer oder mehreren Positionen des Doppelbindungssystems Heteroatome wie Stickstoff, Sauerstoff oder Schwefel aufweisen, zählen zu den Heterokumulenen.
Eigenschaften
Je mehr kumulierte Doppelbindungen ein Kumulen enthält, desto mehr vertieft sich dessen Farbe, ähnlich wie bei den konjugierten Polyenen. Die Kumulene reagieren sehr leicht mit Brom, Bromwasserstoff und Ozon, gegenüber Sauerstoff sind sie jedoch relativ beständig.[2]
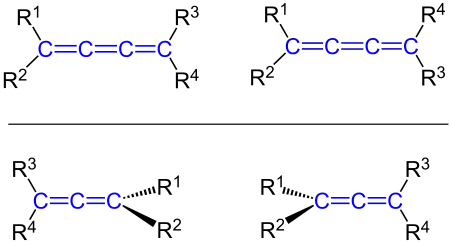
Isomerie
An beiden endständigen sp2-hybridisierten Kohlenstoffatomen unterschiedlich substituierte Kumulene mit einer ungeraden Anzahl kumulierter Doppelbindungen bilden cis-trans-Isomere. An beiden endständigen sp2-hybridisierten Kohlenstoffatomen unterschiedlich substituierte Kumulene mit einer geraden Anzahl kumulierter Doppelbindungen sind hingegen axial chiral und bilden Enantiomere.[4]
Vorkommen
Das Strukturmotiv der Kumulene findet sich in einigen Naturstoffen, vor allem in Pilzen und Algen.[2]
Verwendung
Im Labor und in der Technik finden vor allem die Heterokumulene (Kumulene mit Heteroatomen, z. B. Carbodiimide, Isocyanate, Ketene) Anwendung.
Einzelnachweise
- Ivan Ernest: Bindung, Struktur und Reaktionsmechanismen in der organischen Chemie, Springer-Verlag, 1972, ISBN 3-211-81060-9, S. 28.
- Otto-Albrecht Neumüller (Hrsg.): Römpps Chemie-Lexikon. Band 3: H–L. 8. neubearbeitete und erweiterte Auflage. Franckh'sche Verlagshandlung, Stuttgart 1983, ISBN 3-440-04513-7, S. 2268.
- Eintrag zu Cumulenes. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.C01440 – Version: 2.1.5.
- Bernhard Testa: Grundlagen der Organischen Stereochemie, Verlag Chemie, Weinheim, 1983, ISBN 3-527-25935-X, S. 72–73.