Alectinib
Alectinib (Handelsname Alecensa) ist ein Arzneistoff, der zur Behandlung von Patienten mit nicht-kleinzelligem Lungenkarzinom (NSCLC, non-small cell lung cancer), die eine Mutation im ALK-Gen (ALK = Anaplastic Lymphoma Kinase) aufweisen, eingesetzt wird. Es handelt sich um einen Tyrosinkinase-Inhibitor (TKI), der peroral anwendbar ist.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
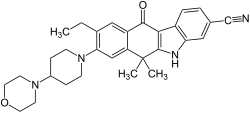 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Freiname | Alectinib | ||||||||||||||||||
| Andere Namen |
9-Ethyl-6,6-dimethyl-8-(4-morpholin-4-ylpiperidin-1-yl)-11-oxo-5H-benzo[b]carbazol-3-carbonitril (IUPAC) | ||||||||||||||||||
| Summenformel | C30H34N4O2 | ||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff (Hydrochlorid)[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code |
L01L01XE36 | ||||||||||||||||||
| Wirkstoffklasse | |||||||||||||||||||
| Wirkmechanismus | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 482,628 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Schmelzpunkt |
>265 °C (Zersetzung)[1] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Hintergrund
Etwa 5 Prozent der Patienten mit NSCLC weisen Mutationen im ALK-Gen auf. Häufig handelt es sich bei diesen Patienten um lebenslange Nichtraucher. Im Jahr 2011 wurde mit Crizotinib (Handelsname Xalkori, Firma Pfizer) erstmals ein spezifischer TKI, der gegen mutiertes ALK-Protein wirkt, zur Behandlung dieser Patienten zugelassen. Jedoch zeigte sich, dass die Wirkung von Crizotinib in der Regel nicht sehr lange anhält. Meist schon innerhalb des ersten Therapiejahres kommt es zu einem Wirkungsverlust des Medikaments. Verschiedene molekulare Resistenzmechanismen wurden als Ursache hierfür beschrieben: Amplifikation des mutierten ALK-Gens, die Ausbildung anderer ALK-Mutationen, die durch Crizotinib nicht gehemmt werden können, und die Aktivierung von alternativen Signaltransduktionswegen (EGFR, KIT etc.).[4]
Die Entwicklung von Genmutationen, die eine Resistenz gegen die jeweiligen Inhibitor vermitteln, ist ein bei TKI-Therapie häufig zu beobachtendes Phänomen. Im Falle von Crizotinib sind eine ganze Reihe von ALK-Mutationen bekannt, die eine Crizotinib-Resistenz vermitteln: G1269A, L1152R, G1202R, F1174C, I1171T, S1206Y, T1156Tins und andere (G1269A bedeutet: Mutation, die zum Austausch der Aminosäure Glycin (G) gegen Alanin (A) an Position 1269 des ALK-Proteins führt). Etwa ein Drittel der Crizotinib-Resistenzen scheinen durch solche Mutationen vermittelt.[4] Auch in Reaktion hierauf wurden von verschiedenen Pharmafirmen sogenannte second generation ALK-Inhibitoren entwickelt. Einer davon war Alectinib.
Studienlage, Zulassung
Alectinib zeigte in verschiedenen kleineren Studien eine deutliche Wirksamkeit und wurde im Jahr 2013 zuerst in Japan als orphan drug zur Behandlung ALK-mutierter NSCLC-Patienten, bei denen eine Crizotinib-Gabe nicht sinnvoll oder möglich war, zugelassen. Im September 2014 erfolgte in Japan die vollständige Zulassung. Am 11. Dezember 2015 erteilte die US-amerikanische Food and Drug Administration (FDA) eine Zulassung in den Vereinigten Staaten für die Zweitlinientherapie bzw. bei Unverträglichkeit von Crizotinib.[5] Die Europäische Kommission ließ Alecensa am 21. Februar 2017 für die Länder der EU zu.[6][7]
Im August 2017 wurden im New England Journal of Medicine die Ergebnisse der sogenannten ALEX-Therapiestudie veröffentlicht, die von der Firma Hoffmann-La Roche gesponsert worden war, und in deren Rahmen ALK-mutierte NSCLC-Patienten in der Erstlinientherapie behandelt wurden. Die Therapiestudie war zweiarmig angelegt und die Patienten erhielten entweder 250 mg Crizotinib einmal täglich oder 600 mg Alectinib zweimal täglich (jeweils die Standarddosis). In jeden Studienarm wurden etwa 150 Patienten aufgenommen. Das progressionsfreie Überleben nach einem Jahr war in der ersteren Gruppe signifikant besser als in der letztgenannten (68,4 % versus 48,7 %, p<0,001). In der Alectinib-Gruppe zeigten 18 Prozent Hinweise für eine Progression der Erkrankung im ZNS (neu aufgetretene oder größer werdende ZNS-Metastasen), während dies in der Crizotinib-Gruppe 45 Prozent waren. Ein Kritikpunkt an der Studie war, dass die Studienauswertung sehr früh erfolgte, so dass das mediane progressionsfreie Überleben in der Alectinib-Gruppe nicht erreicht worden war. Die Untersucher schlussfolgerten, dass Alectinib eine bessere Wirksamkeit (und zugleich niedrigere Toxizität) als Crizotinib hatte.[8]
Nebenwirkungen
Die Standard-Tagesdosis ist 1200 mg. Bei geringgradiger oder mäßiggradiger Einschränkung der Nieren- oder Leberfunktion ist keine Dosisreduktion erforderlich.[7] Insgesamt gilt die Substanz als relativ gut verträglich und verursacht – wie alle TKI – nicht die typischen Nebenwirkungen von herkömmlichen Zytostatika. Am häufigsten wurden beschrieben: Anämie, Muskelschmerzen, Leberwerterhöhungen (Bilirubin, Transaminasen), Ödeme, Übelkeit, u. a.[8]
Frühe Nutzenbewertung nach § 35a SGB V
Das IQWiG hat in mehreren Dossierbewertungen und Addenda untersucht, ob Alectinib in der Behandlung Erwachsener mit ALK-positivem, fortgeschrittenem NSCLC gegenüber den vom Gemeinsamen Bundesausschuss (G-BA) festgelegten zweckmäßigen Vergleichstherapien einen Zusatznutzen hat. Demnach gibt es bei der Erstlinienbehandlung Erwachsener mit ALK-positivem, fortgeschrittenem NSCLC einen Anhaltspunkt für einen nicht quantifizierbaren Zusatznutzen.[9] Der G-BA hat sich dem Bewertungsergebnis angeschlossen.[10] Für Crizotinib- und Chemotherapie-vorbehandelte Erwachsene, für die Behandlung mit Docetaxel oder Pemetrexed infrage kommt, gibt es einen Anhaltspunkt für beträchtlichen Zusatznutzen.[11][12] Kommt nach einer Vorbehandlung mit einer platinbasierten Chemotherapie eine Behandlung mit Docetaxel oder Pemetrexed nicht infrage, ist ein Zusatznutzen mangels geeigneter Studiendaten nicht belegt. Auch für Crizotinib-vorbehandelte Patienten, die noch keine Chemotherapie erhalten haben, ist ein Zusatznutzen nicht belegt.[13][14]
Sonstiges
Verwendet wird der Wirkstoff als Alectinibhydrochlorid,[15] einem weißen bis gelbweißen Pulver mit Klümpchen. Es ist leicht hygroskopisch und weist eine geringe Löslichkeit auf in wässrigen Pufferlösungen über deren gesamten pH-Bereich. Der pKs-Wert für die freie Base beträgt 7,05.[16]
Einzelnachweise
- Eintrag zu (Alectinib) Hydrochloride bei Toronto Research Chemicals, abgerufen am 22. Januar 2022 (PDF).
- Daniel Purich: The Inhibitor Index: A Desk Reference on Enzyme Inhibitors, Receptor Antagonists, Drugs, Toxins, Poisons, Biologics, and Therapeutic Leads. CRC Press, 2017, ISBN 978-1-351-73068-6, S. 71 (eingeschränkte Vorschau in der Google-Buchsuche).
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Zilan Song, Meining Wang, Ao Zhang: Alectinib: a novel second generation anaplastic lymphoma kinase (ALK) inhibitor for overcoming clinically-acquired resistance. In: Acta Pharmaceutica Sinica B. Band 5, Nr. 1, Januar 2015, S. 34–37, doi:10.1016/j.apsb.2014.12.007 (englisch).
- FDA approves new oral therapy to treat ALK-positive lung cancer. FDA, 11. Dezember 2015, abgerufen am 22. September 2017 (englisch).
- Media release: Roche receives EU approval of Alecensa (alectinib) for people with previously treated ALK-positive non-small cell lung cancer. Roche, 21. Februar 2017, abgerufen am 22. September 2017 (englisch).
- Annex I: Zusammenfassung der Merkmale des Arzneimittels. (PDF) EMA, abgerufen am 22. September 2017.
- Solange Peters, D. Ross Camidge, Alice T. Shaw, Shirish Gadgeel, Jin S. Ahn, Dong-Wan Kim, Sai-Hong I. Ou, Maurice Pérol, Rafal Dziadziuszko, Rafael Rosell, Ali Zeaiter, Emmanuel Mitry, Sophie Golding, Bogdana Balas, Johannes Noe, Peter N. Morcos, Tony Mok, for the ALEX Trial Investigators: Alectinib versus Crizotinib in Untreated ALK-Positive Non–Small-Cell Lung Cancer. In: The New England Journal of Medicine. Band 377, 31. August 2017, S. 829–838, doi:10.1056/NEJMoa1704795 (englisch).
- A17-67 Alectinib (nicht kleinzelliges Lungenkarzinom) - Nutzenbewertung gemäß § 35a SGB V, abgerufen am 31. August 2018.
- Beschluss des Gemeinsamen Bundesausschusses vom 21.06.2018 über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Alectinib (neues Anwendungsgebiet: Erstlinienbehandlung nicht-kleinzelliges Lungenkarzinom), abgerufen am 31. August 2018.
- A17-44 Alectinib (nicht kleinzelliges Lungenkarzinom) - Addendum zum Auftrag A17-19, abgerufen am 31. August 2018.
- Beschluss des Gemeinsamen Bundesausschusses vom 19.10.2017 über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII – Alectinib, abgerufen am 31. August 2018.
- A17-19 Alectinib (NSCLC) - Nutzenbewertung gemäß §35a SGB V, abgerufen am 3. September 2018.
- Beschluss des Gemeinsamen Bundesausschusses vom 06.04.2017 über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Alectinib, abgerufen am 3. September 2018.
- Externe Identifikatoren von bzw. Datenbank-Links zu Alectinibhydrochlorid: CAS-Nummer: 1256589-74-8, EG-Nummer: 814-550-1, ECHA-InfoCard: 100.247.762, PubChem: 53239799, ChemSpider: 26332606, Wikidata: Q27104897.
- Assessment report Alecensa, abgerufen am 13. Januar 2022.