Acetolactat-Synthase
Die Acetolactat-Synthase (abgekürzt ALS oder AHAS) ist ein Enzym, das bei vielen Pro- und Eukaryoten an der Bildung der verzweigtkettigen Aminosäuren Valin, Leucin und Isoleucin beteiligt ist. Das Enzym kommt bei Pflanzen und einzelligen Organismen vor. Im Menschen wurde ein homologes Gen identifiziert, das möglicherweise mit der Krankheit CADASIL in Zusammenhang steht.[1] In diesem Artikel ist das Enzym aus der Bäckerhefe, Saccharomyces cerevisiae, abgebildet.
| Acetolactat-Synthase | ||
|---|---|---|
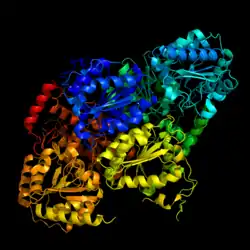 | ||
| Bändermodell nach PDB 1n0h | ||
| Masse/Länge Primärstruktur | 74937 Da, 677 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer | |
| Kofaktor | Thiaminpyrophosphat, Mg2+ | |
| Bezeichner | ||
| Gen-Name(n) | ILV2 | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 2.2.1.6, Transketolase | |
| Reaktionsart | Decarboxylierung | |
| Substrat | Pyruvat | |
| Produkte | α-Acetolactat, CO2 | |
Aufbau und Funktion
Das Enzym ist aus zwei Untereinheiten aufgebaut und enthält Thiaminpyrophosphat als prosthetische Gruppe.[2]
Die Acetolactat-Synthase katalysiert den ersten Schritt der Synthese von Valin, Leucin und Isoleucin, drei für den Menschen essenzielle Aminosäuren, indem sie CO2 aus zwei Molekülen Pyruvat abspaltet. Dabei wird α-Acetolactat gebildet, welches die Grundlage für den weiteren Syntheseweg bildet.
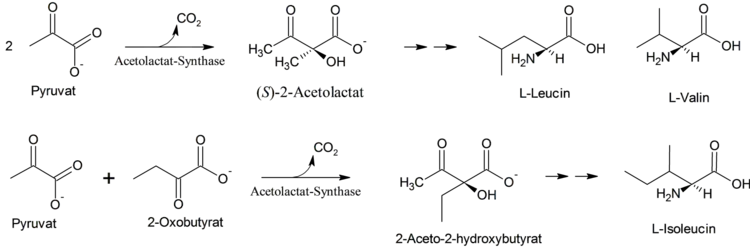
Das Enzym kann durch verschiedene Herbizide gehemmt werden (HRAC-Klasse B). Auf diesem Angriffspunkt beruht die Wirkung der Sulfonylharnstoffe (z. B. Chlorsulfuron) und Imidazolinone (z. B. Imazaquin).[3] Einige Pflanzen sind durch natürliche, oder mittlerweile auch induzierte Mutationen in dem entsprechenden Gen resistent, da bereits bei Austausch einer Aminosäure die Hemmung wirkungslos werden kann, das Enzym aber seine Funktion nicht verlieren muss.[4]
Darüber hinaus wird bei einigen Bakterien der Gattungen Enterobacter, Aeromonas, Bacillus und Serratia in der gemischten Säuregärung aus Pyruvat als Endprodukt 2,3-Butandiol gebildet, wobei der erste Schritt ebenfalls von der Acetolactat-Synthase katalysiert wird.[5]
Einzelnachweise
- A. Joutel, A. Ducros, S. Alamowitch, C. Cruaud, V. Domenga, E. Maréchal, K. Vahedi, H. Chabriat, M. G. Bousser, E. Tournier-Lasserve: A human homolog of bacterial acetolactate synthase genes maps within the CADASIL critical region. In: Genomics. Band 38, Nr. 2, 1. Dezember 1996, S. 192–198, doi:10.1006/geno.1996.0615, PMID 8954801.
- Siew Siew Pang, Luke W. Guddat, Ronald G. Duggleby: Molecular basis of sulfonylurea herbicide inhibition of acetohydroxyacid synthase. In: The Journal of Biological Chemistry. Band 278, Nr. 9, 28. Februar 2003, S. 7639–7644, doi:10.1074/jbc.M211648200, PMID 12496246.
- Hans Walter Heldt, Birgit Piechulla: Pflanzenbiochemie. Springer, Berlin, Heidelberg 2015, ISBN 978-3-662-44397-2, S. 281, doi:10.1007/978-3-662-44398-9_1.
- David P. Clark, Nanette Jean Pazdernik: Molekulare Biotechnologie: Grundlagen und Anwendungen. Spektrum, Akad. Verl, Heidelberg 2009, ISBN 978-3-8274-2128-9.
- Georg Fuchs, Hans Günter Schlegel, Thomas Eitinger (Hrsg.): Allgemeine Mikrobiologie. 9., vollst. überarb. und erw. Auflage. Thieme, Stuttgart, New York 2014, ISBN 978-3-13-444609-8.