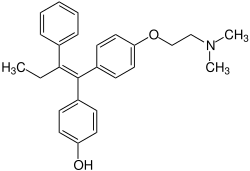
4-Hydroxytamoxifen
4-Hydroxytamoxifen, ebenso bekannt als Hydroxytamoxifen, abgekürzt als 4-OHT, 4-HT, OHTAM, internationaler Freiname Afimoxifen, ist ein selektiver Estrogenrezeptormodulator aus der Gruppe der Stilbenderivate. Diese sind wegen ihrer antiesterogenen Aktivitäten sowohl als Kontrazeptiva als auch Therapeutika zur Behandlung benigner Brusterkrankungen und Mammatumoren interessant.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Afimoxifen | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C26H29NO2 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 387,52 g·mol−1 | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
Wasser: 3,03 mg·l−1 (25 °C)[6] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Historie
Bereits 1973[7] wurde im Tierversuch der Metabolismus von Tamoxifen untersucht und 1977[8] konnte Hydroxytamoxifen als Haupt-Metabolit neben Desmethyl-hydroxytamoxifen (Endoxifen) bestätigt werden. Weitere Untersuchungen von 1979[9] kommen zum gleichen Ergebnis und heben die starke Rezeptorbindung von 4-Hydroxytamoxifen hervor. Schon 1978 wurden Patentschutz für eine Zubereitung[4] und für die Synthese mit Anwendung[10] eingereicht.
Klinische Angaben
Potentielle Anwendungsgebiete
4-Hydroxytamoxifen ist wie Tamoxifen zur Behandlung hormonabhängiger Tumore vorgesehen. Wegen der wesentlich stärkeren Wirksamkeit von 4-Hydroxytamoxifen bei gleichzeitig schnellerer Metabolisierung nach oraler Einnahme im Vergleich zu Tamoxifen sind topische Anwendungen als Gel[4] oder transdermal als Pflaster[11] vorzuziehen. In den USA wurde 2007 die Zubereitung TamoGel zur Behandlung zyklusabhängiger Brustschmerzen bei prämenopausalen Frauen in einer Phase-II-Studie untersucht,[12] ein weiteres 4-Hydroxytamoxifen-Gel zur Herabsetzung der radiographischen Brustgewebsdichte bei Frauen mit einer Gewebsdichte der BI-RADS Kategorie C oder D ist seit August 2017 in der klinischen Phase III.[13][14]
Wechselwirkungen
Als Hormonrezeptormodulator kann 4-Hydroxytamoxifen ebenso wie Tamoxifen potenziell die Wirkung anderer Hormonpräparate beeinflussen. Insbesondere bei gleichzeitiger Einnahme von Estrogenen mit Tamoxifenderivaten kann eine wechselseitige Wirkungsabschwächung beobachtet werden.
Chemie
Synthese
Die älteren Synthese von 4-Hydroxytamoxifen nutzen das gleiche Prinzip wie die Tamoxifensynthesen: Durch Umsetzung eines 1,2-Diphenylbutanon-Derivats mit einer Aryl-Grignard-Verbindung wird das Triphenylbuten-Gerüst aufgebaut.[15] Da aus dem intermediären tertiären Diphenylcarbinol durch Eliminierung von Wasser nach einem ionischen Reaktionsmechanismus das Olefin gebildet wird, entstehen immer Z/E-Gemische im Verhältnis Z : E = 3 : 2.[16] Isomerentrennungen mittels Chromatografie werden beschrieben.[17]
Drei Strategien werden mit verschiedenen Schutzgruppen für Phenole angewandt:
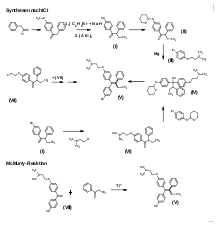
- Einführung der Dimethylaminoethoxyphenyl-Gruppe: Über die Grignard-Verbindung aus Dimethylaminoethoxybrombenzol der Formel (III) und 1-Tetrahydropyranyloxyphenyl-2-phenylbutanon der Formel (II) wird die Carbinol-Vorstufe der Formel (IV) von Hydroxytamoxifen der Formel (V) aufgebaut.[15] Der zentrale Baustein des Hydroxyphenyl-2-phenylbutanons der Formel (I) wird über mehrere Stufen[10] aus Anisol und Phenylessigsäure dargestellt (siehe Reaktionsschema).
- Einführung des Phenolrestes: Beim Baustein der Formel (I) kann auch gleich die basische Seitenkette mittels Dimethylaminoethylchlorid eingeführt werden. Das erhaltene Keton der Formel (VI) liefert mit der Grignardverbindung aus Tetrahydropyranyloxybrombenzol der Formel (VII) ebenfalls das Carbinol der Formel (IV). Dieser Kategorie sind auch neuere Verfahren[17] zuzuordnen, die von einem Diphenylbutanonderivat der Formel (VII) mit einer Chlorethoxy-Seitenkette ausgehen. Nach analoger Reaktionsfolge wird die Aminogruppe erst in der Endstufe eingeführt.[18]
- McMurry-Reaktion zum Aufbau des Olefins: In formelmäßig einfacher Form soll (Z)-4-Hydroxytamoxifen der Formel (V) durch Kopplung des Benzophenonderivats der Formel (VIII) mit Propiophenon durch niedervalente Titanverbindungen gebildet werden.[5]
Stabilität
Schon lange ist bekannt, dass die antiestrogene Wirkung von 4-Hydroxytamoxifen von dessen stereochemischen Reinheit abhängt,[15] da das E-Isomere als estrogene Verbindung agiert. Jedoch ist Hydroxytamoxifen sowohl in Lösung als auch als Festsubstanz konformativ nicht stabil. Frisch synthetisiertes (Z)-4-Hydroxytamoxifen soll einen Schmelzpunkt von 142–144 °C[4] haben. Doch bereits nach einer Lagerzeit von einigen Wochen bei Raumtemperatur sinkt er um 4 °C, da der E-Gehalt zunimmt.
Mit Ketonen, insbesondere mit Mesityloxid bildet (Z)-4-Hydroxytamoxifen bei Raumtemperatur stabile Solvate,[16] die auch zur Reinigung geeignet sind. Die Trennung des Isomerengemisches gelingt auf der Vorstufe der Chlorethoxyverbindung[18][19](CAS-Nummer: 119757-57-2) nach Benzoylierung der Phenolgruppe mit Benzoylchlorid. Alkoholyse des Phenolesters führt unter kinetischer Kontrolle zur bevorzugten Fällung der schwerer löslichen (E)-Benzoylverbindung. Aus dieser kann nach Hydrolyse des Phenolesters und Substitution des Chloratoms mittels Dimethylamin das Z-Isomere gewonnen werden, das aus dem Keton das entsprechende gereinigte Solvat ergibt.
Literatur
- R. Mansel, A. Goyal, E. L. Nestour, V. Masini-Etévé, K. O’Connell: A phase II trial of Afimoxifene (4-hydroxytamoxifen gel) for cyclical mastalgia in premenopausal women. In: Breast Cancer Research and Treatment. Band 106, Nr. 3, 2007, S. 389–397, doi:10.1007/s10549-007-9507-x, PMID 17351746.
Einzelnachweise
- Datenblatt (Z)-4-Hydroxytamoxifen bei Sigma-Aldrich, abgerufen am 19. Oktober 2016 (PDF).
- Eintrag zu (E)-4-Hydroxytamoxifen bei ChemicalBook, abgerufen am 3. Dezember 2017.
- (E/Z)-4-hydroxy Tamoxifen (CAS-Nummer: 68392-35-8). In: caymanchem.com. Abgerufen am 1. Dezember 2017 (englisch).
- Patent DE2807599: Pharmazeutische Zusammensetzungen. Veröffentlicht am 31. August 1978, Erfinder: Dora Nellie Richardson.
- S. Gauthier, J. Mailhot, F. Labrie: New Highly Stereoselective Synthesis of (Z)-4-Hydroxytamoxifen and (Z)-4-Hydroxytoremifene via McMurry Reaction. In: The Journal of Organic Chemistry. Band 61, Nr. 11, 1996, S. 3890–3893, doi:10.1021/jo952279l.
- Eintrag zu Afimoxifene in der DrugBank der University of Alberta, abgerufen am 3. Dezember 2017.
- J. M. Fromson, S. Pearson, S. Bramah: The Metabolism of Tamoxifen (I.C.I. 46,474) Part I: In Laboratory Animals. In: Xenobiotica. Band 3, Nr. 11, 1973, S. 693–709, doi:10.3109/00498257309151594, PMID 4361333.
- V. C. Jordan, Margret M. Collins, L. Rowsby, G. Prestwich: A Monohydroxylated Metabolite of Tamoxifen with Potent Antioestrogenic Activity. In: Journal of Endocrinology. Band 75, Nr. 2, 1977, ISSN 0022-0795, S. 305–316, doi:10.1677/joe.0.0750305, PMID 591813.
- J.-L. Borgna, H. Rochefort: Biologie moléculaire. Occupation in vivo des réscepteurs æstrogènes par des métabolites hydroxylés du tamoxifène. In: Comptes Rendus Des Seances De l’Academie Des Sciences. Serie D, Sciences Naturelles. Band 289, Nr. 15, 1979, ISSN 0567-655X, S. 1141–1144, PMID 121266 (französisch).
- Patent DE2835536: Verfahren zur Erzielung eines antiöstrogenen Effekts bei Warmblütern, hierfür geeignete Zusammensetzungen und Verbindungen sowie Verfahren zur Herstellung dieser Verbindungen. Veröffentlicht am 1. März 1979, Erfinder: Dora Nellie Richardson.
- Patent WO9524187: Plaster-shaped transdermal system with a tamoxifen derivative. Veröffentlicht am 14. September 1995, Anmelder: Hexal Pharma GmbH, Erfinder: W. Fischer, K. Klokkers.
- R. Mansel et al.: A phase II trial of Afimoxifene (4-hydroxytamoxifen gel) for cyclical mastalgia in premenopausal women. Breast Cancer Res. Treat. 106 (3): S. 389–397 (2007). doi:10.1007/s10549-007-9507-x.
- Klinische Studie (Phase III): Trial of 4-OHT Gel in Women Aimed at Reducing Dense Breast Tissue (4WARD) bei Clinicaltrials.gov der NIH.
- Afimoxifene. In: adisinsight.springer.com. Springer-Verlag, abgerufen am 3. Dezember 2017 (englisch).
- Peter C. Ruenitz, Jerome R. Bagley, Corwin M. Mokler: Estrogenic and antiestrogenic activity of monophenolic analogs of tamoxifen, [(Z)-2-[p-(1,2-diphenyl-1-butenyl)phenoxy]-N,N-dimethylethylamine. In: J. Med. Chem. Band 25, Nr. 9, 1982, S. 1076–1060, doi:10.1021/jm00351a010, PMID 7131484 (englisch).
- Patent EP0287690: Stabile Lösungsmitteladdukte von Z-1-(p-beta-Dimethylamino-ethoxyphenyl)-1-(p-hydroxyphenyl)-2-phenylbut-1-en. Veröffentlicht am 26. Oktober 1988, Anmelder: Heumann Pharma GmbH Co., Erfinder: Ingomar Grafe, Helmut Schickaneder, Peter W. Jungblut, Kurt Henning Ahrens.
- Patent WO2008070463: Endoxifen methods and compositions. Veröffentlicht am 12. Juni 2008, Anmelder: JINA PHARMACEUTICALS INC., Erfinder: Ahmad Ateeq, Ali Shoukath M, Ahmad Moghis U, Sheikh Saifuddin, Ahmad Imran.
- Shoukath M. Ali, Ateeq Ahmad, Syed Shahabuddin, Moghis U. Ahmad, Saifuddin SheikhImran: Endoxifen is a new potent inhibitor of PKC: A potential therapeutic agent for bipolar disorder. In: Bioorganic & Medicinal Chemistry Letters. Band 20, Nr. 8, 2010, S. 2665–2667, doi:10.1016/j.bmcl.2010.02.024, PMID 20227879 (englisch).
- Patent WO2010135703: Endoxifen methods and compositions in the tratment of mammalian diseases. Veröffentlicht am 28. März 2012, Erfinder: Ahmad, Ateeq; Ali, Shoukath M.; Ahmad, Moghis U.; Sheikh, Saifuddin; Ahmad, Imran (Jina Pharmaceuticals, Inc., USA).