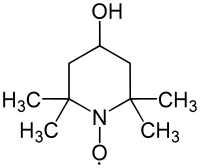
4-Hydroxy-2,2,6,6-tetramethylpiperidinyloxyl
4-Hydroxy-2,2,6,6-tetramethylpiperidinyloxyl (4-Hydroxy-TEMPO) ist ein stabilisiertes Radikal, das als Oxidationsmittel eingesetzt werden kann.[5] Die Reaktivität der Verbindung ähnelt der des 2,2,6,6-Tetramethylpiperidinyloxyl (TEMPO). Die zusätzliche Hydroxygruppe erlaubt eine Verknüpfung an andere Verbindungen.[2]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | 4-Hydroxy-2,2,6,6-tetramethylpiperidinyloxyl | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C9H18NO2 | |||||||||||||||||||||
| Kurzbeschreibung |
orange Kristalle[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 172,24 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,127 g·cm−3[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Gewinnung und Darstellung
Die Synthese geht vom Phoron aus, welches leicht über eine doppelte Aldol-Kondensation aus Aceton gewonnen werden kann.[6] Im ersten Schritt erfolgt in Gegenwart von Ammoniak eine Cyclisierung zum 2,2,6,6-Tetramethyl-piperidin-4-on. Dieses wird anschließend mittels Natriumborhydrid zum 2,2,6,6-Tetramethyl-piperidin-4-ol reduziert. Die Zielverbindung ergibt sich im letzten Schritt durch die Oxidation mit Wasserstoffperoxid in Gegenwart von Natriumwolframat.[3]

Eigenschaften
4-Hydroxy-2,2,6,6-tetramethylpiperidinyloxyl bildet orange Kristalle, die bei 70 °C schmelzen. Ab 140 °C wird eine Zersetzung beobachtet.[2]
Verwendung
Die Verbindung wird als Inhibitor bei radikalischen Polymerisationsreaktionen angewendet.[2] Sie wirkt dabei als Radikalfänger und Regler für einen kontrollierten Polymerisationsverlauf.[3] So kann es als Reaktionsstopper bei durchgehenden Polymerisationsreaktionen eingesetzt werden.[7] In der organischen Synthese wirkt es als katalytisches Oxidationsmittel bei der selektiven Oxidation von primären Alkoholen zu Aldehyden in Gegenwart von Natriumhypochlorit oder 1,4-Benzochinon.[3] Mit aktivierten Kohlenwasserstoffen, wie Cyclohexen reagiert die Substanz unter H-Abstraktion zu den entsprechenden radikalischen Intermediaten, die mit weiterem 4-Hydroxy-TEMPO zur N-Alkoxyaminverbindung rekombinieren.[8][9]
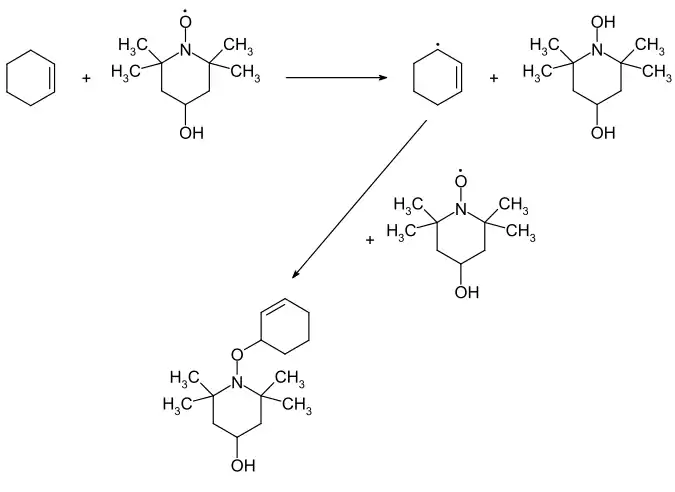
Durch die OH-Funktionalität ist ein Einbau in Polymerketten möglich, wodurch polymerbasierende TEMPO-Materialien erhalten werden. Diese können zur Oxidation von Alkoholen zu den entsprechenden Aldehyden und Ketonen verwendet werden.[10] Eine medizinische Anwendung als blutdrucksenkender Wirkstoff wurde am Tiermodell untersucht.[11]
Eine Anwendung von TEMPOL gegen den SARS-CoV-2-Virus, dem Auslöser von COVID-19, wird untersucht.[12]
Einzelnachweise
- Eintrag zu HYDROXY TETRAMETHYLPIPERIDINE OXIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 3. Juni 2020.
- Evonik Industries AG: GPS Safety Summary 4-HT, März 2014.
- Eintrag zu 4-Hydroxy-2,2,6,6-tetramethyl-1-piperidinyloxyl in e-EROS Encyclopedia of Reagents for Organic Synthesis, 1999–2013, John Wiley and Sons, Inc., abgerufen am 10. Februar 2016.
- Eintrag zu 4-Hydroxy-2,2,6,6-tetramethylpiperidinoxyl in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- Ciriminna, R.; Pagliaro, M.: Industrial Oxidations with Organocatalyst TEMPO and Its Derivatives in Org. Process Res. Dev. 14 (2010) 245–251, doi:10.1021/op900059x.
- L. F. Fieser und M. Fieser, Lehrbuch der Organischen Chemie, übersetzt und bearbeitet von H. R. Hensel, S. 222, Verlag Chemie, Weinheim, 1954.
- Platkowski, K.; Reichert, K.-H.: Untersuchungen zum Stoppen der radikalischen Polymerisation von Methylmethacrylat mit dem Inhibitor 4-Hydroxytempo in Chem. Ing. Techn. 71 (1999) 493–496, doi:10.1002/cite.330710516.
- Babiarz, J.E.; Cunkle, G.T.; DeBellis, A D.; Eveland, D.; Pastor, S.D.; Shum, S.P.: The Thermal Reaction of Sterically Hindered Nitroxyl Radicals with Allylic and Benzylic Substrates: Experimental and Computational Evidence for Divergent Mechanisms in J. Org. Chem. 67 (2002) 6831–6834, doi:10.1021/jo020426r.
- Vogler, T.; Studer, A.: Applications of TEMPO in Synthesis in Synthesis 2008, 1979–1993, doi:10.1055/s-2008-1078445.
- Tanyeli,C.; Gumus, A.: Synthesis of polymer-supported TEMPO catalysts and their application in the oxidation of various alcohols in Tetrahedron Letters 44 (2003) 1639–1642, doi:10.1016/S0040-4039(03)00003-0.
- Wilcox, C.S.; Pearlman, A.: Chemistry and Antihypertensive Effects of Tempol and Other Nitroxides in Pharmacol. Rev. 60 (2008) 418–469, doi:10.1124/pr.108.000240.
- Nunziata Maio/Bernard A. P. Lafont/Debangsu Sil et al., Fe-S cofactors in the SARS-CoV-2 RNA-dependent RNA polymerase are potential antiviral targets, Science vom 3. Juni 2021, DOI: 10.1126/science.abi5224


