3-Brompropen
3-Brompropen (Trivialname: Allylbromid) ist eine organisch-chemische Verbindung aus der Gruppe der Alkylhalogenide.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | ||||||||||||||||
| Name | 3-Brompropen | |||||||||||||||
| Andere Namen |
Allylbromid | |||||||||||||||
| Summenformel | C3H5Br | |||||||||||||||
| Kurzbeschreibung |
farblose übelriechende Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 120,99 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
1,40 g·cm−3 (20 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
70 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
schwer löslich in Wasser[1] | |||||||||||||||
| Brechungsindex |
1,4697 (20 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
12,2 kJ/mol[3] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Gewinnung und Darstellung
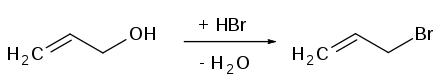
Die Synthese von 3-Brompropen gelingt im Labor- sowie industriellen Maßstab in einer SN1'-Reaktion aus Allylalkohol und Bromwasserstoffsäure.[4] Dabei wird die OH-Gruppe des Allylalkohols zunächst protoniert und unter Abspaltung von Wasser entsteht ein Allylkation, welches anschließend mit einem Bromidion zum Produkt reagiert. Das Produkt kann durch Extraktion isoliert und durch Destillation gereinigt werden.[5]
Alternativ kann die Verbindung auch über eine Halogenaustauschreaktion aus Allylchlorid und Bromwasserstoffsäure oder Natriumbromid in Gegenwart eines Kupfer- und Phasentransferkatalysators hergestellt werden.[4]
Eigenschaften
3-Brompropen ist eine farblose, leicht ölige Flüssigkeit mit einem charakteristisch süßlichen, leicht stechenden Geruch. An feuchter Luft hydrolysiert es sehr langsam zu Bromwasserstoff und Allylalkohol. Als Alkylierungsmittel kann es den Körper nachhaltig schädigen und ist daher als giftig eingestuft.[6]
Sicherheitstechnische Kenngrößen
3-Brompropen bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei −1 °C.[1][7] Der Explosionsbereich liegt zwischen 4,3 Vol.‑% (215 g/m3) als untere Explosionsgrenze (UEG) und 7,3 Vol.‑% (370 g/m3) als obere Explosionsgrenze (OEG).[1][7] Die Zündtemperatur beträgt 295 °C.[1][7] Der Stoff fällt somit in die Temperaturklasse T3.
Verwendung
3-Brompropen wird in der organischen Synthesechemie meist zur Einführung der Allylgruppe verwendet, die eine häufig verwendete Schutzgruppe für Alkohole und Amine ist.[5] Die Verbindung ist ein Ausgangsstoff in den Synthesen von Arzneistoffen wie Methoxohexytal, Nedocromil, Secobarbital und Thiamylal.[4]
Einzelnachweise
- Eintrag zu Allylbromid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2018. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-68.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-23.
- Yoffe, D.; Frim, R.; Ukeles, S.D.; Dagani, M.J.; Barda, H.J.; Benya, T.J.; Sanders, D.C.: Bromine Compounds, in: Ullmanns Enzyklopädie der Technischen Chemie, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2013; doi:10.1002/14356007.a04_405.pub2.
- Eintrag zu ALLYL BROMIDE in der Hazardous Substances Data Bank, abgerufen am 23. Juli 2015 (online auf PubChem).
- T.S.S. Dikshith: Handbook of Chemicals and Safety. CRC Press, 2010, ISBN 978-1-4398-2061-2, S. 65 (eingeschränkte Vorschau in der Google-Buchsuche).
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen – Band 1: Brennbare Flüssigkeiten und Gase, Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003.




