2-Hydroxyfettsäure-Dehydrogenase
2-Hydroxyfettsäure-Dehydrogenasen (auch 2-Hydroxyfettsäure-Oxidasen) sind Enzyme, welche die Dehydrierung von 2-Hydroxystearat zu 2-Oxostearat katalysieren. Diese Enzyme gehören zur Familie der Oxidoreduktasen, wobei die Hydroxygruppe als Donator und NAD+ als Akzeptor fungiert. Man unterscheidet zwischen der (R)-2-Hydroxyfettsäure-Dehydrogenase und der (S)-2-Hydroxyfettsäure-Dehydrogenase.
| 2-Hydroxyfettsäure-Dehydrogenase | ||
|---|---|---|
| Andere Namen |
| |
| Kofaktor | NAD+ | |
| Enzymklassifikationen | ||
| EC, Kategorie | 1.1.1.98, Oxidoreduktase | |
| Reaktionsart | Dehydrierung | |
| Substrat | (R)-2-Hydroxystearat + NAD+ | |
| Produkte | 2-Oxostearat + NADH + H+ | |
| EC, Kategorie | 1.1.1.99, Oxidoreduktase | |
| Reaktionsart | Dehydrierung | |
| Substrat | (S)-2-Hydroxystearat + NAD+ | |
| Produkte | 2-Oxostearat + NADH + H+ | |
| Vorkommen | ||
| Übergeordnetes Taxon | Eukaryoten | |
Die (R)-2-Hydroxyfettsäure-Dehydrogenase darf nicht mit der D-2-Hydroxysäure-Dehydrogenase (auch als D-Lactatdehydrogenase, EC 1.1.99.6) bekannt, verwechselt werden.
Eigenschaften
Vor allem wird die (R)-2-Hydroxyfettsäure-Dehydrogenase zur stereospezifischen Reduktion von 2-Ketocarbonsäuren zu D-2-Hydroxycarbonsäuren verwendet. Das Enzym beteiligt sich an der β-Oxidation.[1] (R)-2-Hydroxyfettsäure-Dehydrogenase ist von physiologischer Bedeutung, da 2-Hydroxyfettsäuren in der Natur in (R)-Konfiguration vorliegen. Außerdem wurde gezeigt, dass 2-Hydroxypalmitat aus der Degradierung von Phytosphingosin in der Leber gebildet wird.[2] Die (S)-2-Hydroxyfettsäure-Dehydrogenase nimmt vermutlich an der α-Oxidation bei der Degradierung von natürlichen und/oder verzweigten langkettigen Fettsäuren teil.[3][4] (S)-2-Hydroxyfettsäuren kommen als Intermediate bei der α-Oxidation von natürlichen Fettsäuren in Pflanzen vor.[5] Die Aktivität dieser Oxidoreduktasen wird durch den Mangel an NAD+ vermindert und hängt außerdem von reduzierten Pyridinnukleotiden ab.[6]
Katalytische Gleichgewichte
-2-Hydroxystearat.svg.png.webp) + NAD+
+ NAD+ 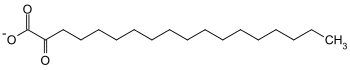 + NADH + H+
+ NADH + H+
(R)-2-Hydroxystearat wird durch die (R)-2-Hydroxyfettsäure-Dehydrogenase oxidiert und dehydriert. Neben dem Reduktionsäquivalent NADH entsteht hierbei 2-Oxostearat. Diese Reaktion ist wichtig für die Fettsäureoxidation.
-2-Hydroxystearat.svg.png.webp) + NAD+
+ NAD+  + NADH + H+
+ NADH + H+
(S)-2-Hydroxystearat wird durch die (S)-2-Hydroxyfettsäure-Dehydrogenase oxidiert und dehydriert. Neben dem Reduktionsäquivalent NADH entsteht hierbei 2-Oxostearat.
Einzelnachweise
- Patent EP0130288: Microbiologically prepared d-2-hydroxy-4-methylpentanoic-acid dehydrogenase, process for its production and its use. Veröffentlicht am 2. März 1988, Erfinder: Wolfgang Leuchtenberger, Werner Hummer, Maria-Regina Kula, Horst Schütte.
- S. Gatt, Y. Barenholz: Degradation of sphingosine bases by cell-free preparations. Alpha-hydroxy palmitic acid, an intermediate of phytosphingosine degradation. In: Biochemical and biophysical research communications. Band 32, Nummer 4, 21. August 1968, S. 588–594, doi:10.1016/0006-291x(68)90277-5, PMID 5682281.
- J. F. Mead, G. M. Levis: A 1 carbon degradation of the long chain fatty acids of brain sphingolipids. In: Journal of Biological Chemistry. Band 238, Mai 1963, S. 1634–1636, PMID 13934294.
- S. C. Tsai, J. H. Herndon, B. W. Uhlendorf, H. M. Fales, C. E. Mize: The formation of alpha-hydroxy phytanic acid from phytanic acid in mammalian tissues. In: Biochemical and biophysical research communications. Band 28, Nummer 4, August 1967, S. 571–577, doi:10.1016/0006-291x(67)90352-x, PMID 6052492.
- L. J. Morris, C. Hitchcock: The stereochemistry of alpha-oxidation of fatty acids in plants. The stereochemistry of biosynthesis of long-chain 2-hydroxyacids. In: European Journal of Biochemistry. Band 4, Nummer 2, 3. April 1968, S. 146–148, doi:10.1111/j.1432-1033.1968.tb00185.x, PMID 5655491.
- Gabriel M. Levis: 2-Hydroxy fatty acid oxidases of rat kidney. In: Biochemical and Biophysical Research Communications. 38, Nr. 3, 6. Februar 1970, S. 470–477. doi:10.1016/0006-291X(70)90737-0. PMID 5443694.