2,4-Diiodphenol
2,4-Diiodphenol ist eine chemische Verbindung, die sowohl zu den Phenolen als auch zu den Halogenaromaten zählt.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2,4-Diiodphenol | ||||||||||||||||||
| Summenformel | C6H4I2O | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 345,9 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Darstellung
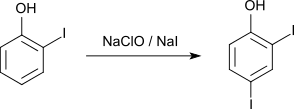
2,4-Diiodphenol kann aus 2-Iodphenol durch Reaktion mit Natriumhypochlorit und Natriumiodid hergestellt werden.[4]
Ein anderer Syntheseweg geht vom 2,4,6-Triiodphenol aus, das mit Zink in Essigsäure zum 2,4-Diiodphenol umgesetzt wird.[5]
Ferner ist die Synthese aus 4-Iodphenol und Schwefelsäure möglich.[1]
Derivate
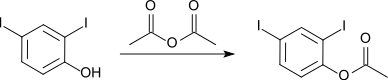
Veresterung mit Essigsäureanhydrid liefert das Acetat, das bei 70–71 °C schmilzt (CAS-Nummer: 36914-80-4).[2][6]
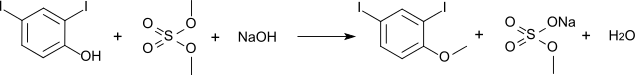
Der Methylether kann durch Methylierung mit Dimethylsulfat hergestellt werden und ist auch unter dem Trivialnamen 2,4-Diiodanisol (CAS-Nummer: 28896-47-1) bekannt. Sein Schmelzpunkt liegt bei 68 °C.[2][6]
Bromierung mit Brom in Essigsäure liefert 2-Brom-4,6-diiodphenol[5] (CAS-Nummer: 89466-01-3), dessen Schmelzpunkt bei 125–127 °C[7] liegt.
Einzelnachweise
- H. Suzuki, R. Goto: "A Convenient Synthetic Method of Certain Aromatic Polyiodo Compounds", in: Bull. Chem. Soc. Japan, 1963, 36 (4), S. 389–391; doi:10.1246/bcsj.36.389.
- Dictionary of organic compounds, S. 2499 (eingeschränkte Vorschau in der Google-Buchsuche).
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von 2,4-diiodophenol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 26. Oktober 2021.
- Kevin J. Edgar, Stephen N. Falling: "An efficient and selective method for the preparation of iodophenols", in: J. Org. Chem., 1990, 55 (18), S. 5287–5291; doi:10.1021/jo00305a026.
- P. Brenans, K. Yeu: "Phénols bromodiiodés, composés trihalogénés symétriques" in C. R. Hebd. Séances Acad. Sci., 1930, 190, S. 1560–1561; Volltext.
- M. P. Brenans: "Sur quelques dérivés iodés du phénol", in: C. R. Hebd. Séances Acad. Sci., 1901, 132, S. 831–833; Volltext.
- Rafael D. C. Gallo, Karimi S. Gebara, Rozanna M. Muzzi, Cristiano Raminelli: "Efficient and selective iodination of phenols promoted by iodine and hydrogen peroxide in water", in: J. Braz. Chem. Soc., 2010, 21 (4); doi:10.1590/S0103-50532010000400026.