1,5-Dibrompentan
1,5-Dibrompentan ist eine chemische Verbindung aus der Gruppe der Halogenalkane. Sie ist aufgebaut aus dem Grundgerüst des n-Pentans mit zwei Bromsubstituenten an den beiden terminalen Positionen.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | ||||||||||||||||
| Name | 1,5-Dibrompentan | |||||||||||||||
| Andere Namen |
Pentamethylenbromid | |||||||||||||||
| Summenformel | C5H10Br2 | |||||||||||||||
| Kurzbeschreibung |
hellbraune Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 229,95 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
1,70 g·cm−3 (20 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
222 °C[1] | |||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser[1] | |||||||||||||||
| Brechungsindex |
1,5126[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Darstellung
1,5-Dibrompentan kann durch die Umsetzung von 1,5-Pentandiol mit Bromwasserstoffsäure synthetisiert werden.[3]
Eine weitere Möglichkeit besteht in der Ringöffnung von Tetrahydropyran mit Bromwasserstoffsäure und Schwefelsäure.[4]
Eigenschaften
1,5-Dibrompentan ist eine bei Raumtemperatur flüssige, farblose Verbindung, die bei einer Temperatur von 222 °C siedet.
Verwendung
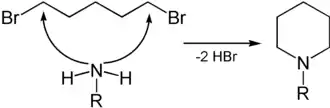
Durch Umsetzung von 1,5-Dibrompentan mit primären Aminen können N-alkylierte Derivate des Piperidins erhalten werden.[5][6]
Thian kann in guter Ausbeute durch die Reaktion von 1,5-Dibrompentan mit Natriumsulfid erhalten werden.[7]
- Reaktion von 1,5-Dibrompentan mit Natriumsulfid zu Thian und Natriumbromid.
Einzelnachweise
- Eintrag zu 1,5-Dibrompentan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- R. Grzeskowiak, G. H. Jeffery, A. I. Vogel: Physical properties and chemical constitution. Part XXXI. Polymethylene dichlorides, dibromides, di-iodides, and dicyanides, in: J. Chem. Soc., 1960, S. 4728–4731; doi:10.1039/JR9600004728.
- A. Hochstetter: Über die Einwirkung von Wasser auf das Pentamethylenbromid, in: Monatsh. Chem., 1902, 23, S. 1071–1074; doi:10.1007/BF01524939.
- D. W. Andrus: Pentamethylen bromide In: Organic Syntheses. 23, 1943, S. 67, doi:10.15227/orgsyn.023.0067; Coll. Vol. 3, 1955, S. 692 (PDF).
- J. v. Braun: Die Aufspaltung cyclischer Basen durch Bromcyan., in: Chem. Ber., 1909, 42, S. 2035–2057; doi:10.1002/cber.19090420286.
- J. Kenyon, H. Phillips, V. P. Pittman: Walden inversion reactions of d-β-butyl, d-β-octyl, and d-benzylmethylcarbinyl p-toluenesulphonates, in: J. Chem. Soc., 1935, S. 1072–1084; doi:10.1039/JR9350001663.
- K. Nagasawa, A. Yoneta: Organosulfur Chemistry. II. Use of Dimethyl Sulfoxide – a Facile Synthesis of Cyclic Sulfides, in: Chem. Pharm. Bull., 1985, 33, S. 5048–5052, doi:10.1248/cpb.33.5048, PDF.
