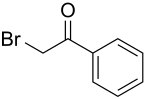
ω-Bromacetophenon
ω-Bromacetophenon ist eine stark augenreizende chemische Verbindung, die in ihrer augenreizenden Wirkung nur wenig hinter Chloracetophenon zurücksteht.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | ω-Bromacetophenon | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C8H7BrO | |||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 199,05 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
1,65 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Darstellung
ω-Bromacetophenon wurde erstmals 1871 von A. Emmerling and C. Engler als „gebromtes Acetophenon“ charakterisiert.[3]
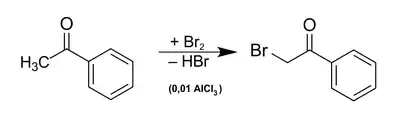
Die Herstellung ist einfach möglich durch säurekatalysierte Bromierung von Acetophenon[4] oder durch Friedel-Crafts-Acylierung von Benzol mit Bromacetylbromid in Gegenwart von Aluminiumchlorid als Katalysator.
Eigenschaften
Chemisch betrachtet ist ω-Bromacetophenon ein aliphatisch-aromatisches Keton. Als Reinsubstanz liegt ω-Bromacetophenon in Form farbloser rhombischer Kristalle vor, das lichtempfindliche Produkt ist häufig gelbbraun verfärbt. In Gegenwart von Basen wie Natriumethanolat geht „Phenacylbromid“ durch Aldolkondensation in „Bromdiphenacyl“ über.[5]
ω-Bromacetophenon wirkt sehr stark haut- und augenreizend.
Verwendung
ω-Bromacetophenon wird hauptsächlich als Zwischenprodukt zur Herstellung von Pharmazeutika und anderen chemischen Verbindungen (zum Beispiel von Indolen durch Bischler-Möhlau-Indolsynthese) verwendet.
Es kann zur Derivatisierung von Carbonsäuren (durch Esterbildung bei pH 8,5) genutzt werden.[6]
Einzelnachweise
- Eintrag zu 2-Bromacetophenon in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Eintrag zu ω-(od. α-)Bromacetophenon. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Mai 2014.
- A. Emmerling, C. Engler: Ueber einige Abkömmlinge des Acetophenons. In: Berichte der Deutschen chemischen Gesellschaft zu Berlin. 4, 147–149 (1871).
- R. L. Cowper, L. H. Davidson: Phencyl Bromide [Acetopheone, α-bromo-] In: Organic Syntheses. 19, 1939, S. 24, doi:10.15227/orgsyn.019.0024; Coll. Vol. 2, 1943, S. 480 (PDF).
- Oskar Widman: Über die Konstitution der sogenannten α- und β-Halogendiphenacyle. In: Justus Liebigs Annalen der Chemie. 400, 86–130 (1913), doi:10.1002/jlac.19134000107.
- J. Bodoprost, H. Rosemeyer: Analysis of Phenacylester Derivatives of Fatty Acids. In: Int. J. Mol. Sci. 2007, 8, 1111–1124.
