Bischler-Möhlau-Indolsynthese
Die Bischler-Möhlau-Indol-Synthese ist eine Reaktion aus dem Bereich der Organischen Chemie und nach den Chemikern August Bischler (1865–1957) und Richard Möhlau (1857–1940) benannt. Sie beschreibt die Darstellung von Indol und dessen Derivaten.
Übersicht
ω-Bromacetophenon lässt sich mit Anilin im Überschuss zu 2-Arylindol umsetzen.[1][2][3][4][5] Dabei werden Wasser und Anilinhydrobromid frei.
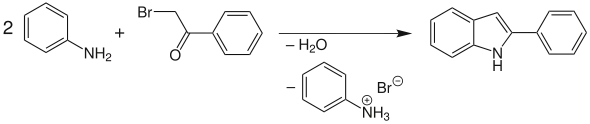
Trotz der Historie dieser klassischen Reaktion erhält sie relativ wenig Aufmerksamkeit im Vergleich zu anderen Indolsynthesen. Der Grund mag vielleicht in den im Gegensatz zu anderen Umsetzungen relativ rauen Reaktionsbedingungen liegen. In späterer Zeit sind wesentlich mildere Methoden entwickelt worden, so der Einsatz von Lithiumbromid als Katalysator oder der Einsatz von Mikrowellen.[6][7]
Reaktionsmechanismus
Obwohl von einfachen Edukten ausgegangen wird, ist der Reaktionsmechanismus relativ komplex.
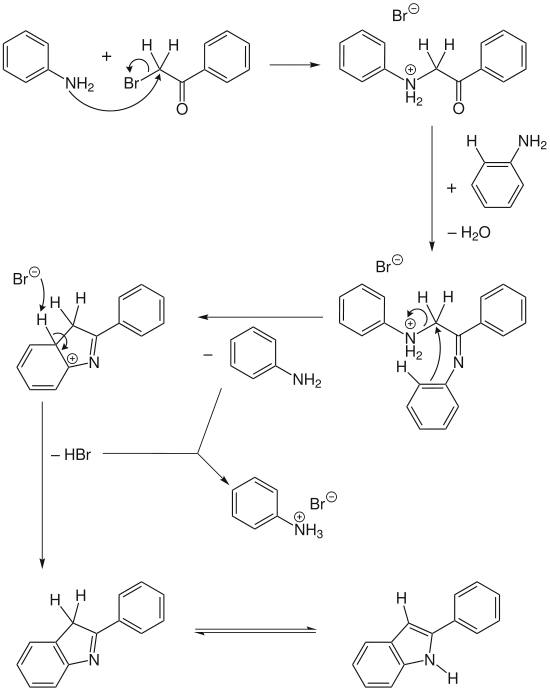
In zwei Schritten wird aus zwei Molekülen Anilin und einem Molekül ω-Bromacetophenon unter Abspaltung von Wasser ein geladenes Anilin als Zwischenprodukt gebildet. Dieses kann elektrophil cyclisieren und ein Intermediat bilden. Durch Aromatisierung und anschließende Tautomerie entsteht das gewünschte Indol. Je ein abgespaltenes Molekül Anilin und Bromwasserstoff bilden dabei das Anilinhydrobromid, ein Salz aus der Klasse der Hydrobromide.
Andere Indolsynthesen
Einzelnachweise
- Aug. Bischler: Ueber die Entstehung einiger substituirter Indole. In: Berichte der deutschen chemischen Gesellschaft. 25, Nr. 2, 1892, S. 2860–2879, doi:10.1002/cber.189202502123.
- Aug. Bischler, P. Fireman: Zur Kenntniss einiger α-β-Diphenylindole. In: Berichte der deutschen chemischen Gesellschaft. 26, Nr. 2, 1893, S. 1336–1349, doi:10.1002/cber.18930260232.
- Richard Möhlau: Ueber die Einwirkung primärer aromatischer Aminbasen auf Acetophenonbromid. In: Berichte der deutschen chemischen Gesellschaft. 14, Nr. 1, 1881, S. 171–175, doi:10.1002/cber.18810140146.
- Richard Möhlau: Ueber Diphenyldiisoindol. In: Berichte der deutschen chemischen Gesellschaft. 15, Nr. 2, 1882, S. 2480–2490, doi:10.1002/cber.188201502204.
- Emil Fischer, Theodor Schmitt: Ueber Pr-2-Phenylindol. In: Berichte der deutschen chemischen Gesellschaft. 21, Nr. 1, 1888, S. 1071–1077, doi:10.1002/cber.188802101200
- Karin Pchalek, Ashley W. Jones, Monique M. T. Wekking, David StC. Black: Synthesis of activated 3-substituted indoles: an optimised one-pot procedure. In: Tetrahedron. 61, Nr. 1, 2005, S. 77–82, doi:10.1016/j.tet.2004.10.060.
- Vellaisamy Sridharan, Subbu Perumal, Carmen Avendaño, J. Carlos Menéndez: Microwave-Assisted, Solvent-Free Bischler Indole Synthesis. In: Synlett. Nr. 1, 2006, S. 0091–0095, doi:10.1055/s-2005-922760.