Zur Rose abziehen
Zur Rose abziehen (auch bis zur Rose abziehen und statt abziehen auch (bis) zur Rose ziehen/

Herkunft des Begriffs
„Abziehen“ bedeutet fachsprachlich „binden“. Damit sich die Masse ganz gleichmäßig erwärmt und auch am heißen Boden oder Rand des Rührgefäßes nicht überhitzt, wird oft empfohlen, nicht mit Rührlöffel oder Schneebesen zu arbeiten, sondern die Masse mit einem Holzspatel oder Teigschaber zu bewegen und dabei fortwährend von Boden und Rand zu lösen („abzuziehen“).[1]
Die Probe erfolgt traditionell, indem man etwas Masse mit einem Kochlöffel entnimmt und darauf pustet; bildet sich dann ein wellen- oder kringelartiges Muster, das an eine Rosenblüte erinnern soll, so ist die gewünschte Konsistenz erreicht. Dieses Verfahren soll aber in der Gastronomie nicht mehr angewandt werden, weil es unhygienisch ist, auf Lebensmittel zu blasen, insbesondere bei Infektionen der oberen Atemwege, wie Husten und Schnupfen. Stattdessen kann mit einem Thermometer gearbeitet werden.[2][3]
Neben dieser – üblicherweise in der modernen Fachliteratur gegebenen – Erklärung der „Rose“ gibt es noch eine weitere Auslegung, der zufolge an der Oberfläche der Masse bei entsprechender Konsistenz ein Muster zurückbleibt, wenn man die Spitze eines Schneebesens hineintaucht und senkrecht wieder herauszieht.[4]
Physikalisch-chemische Vorgänge
Das Abziehen zur Rose hat zum Ziel, das Eigelb als Bindemittel zum Eindicken und – vor allem bei Buttersaucen und anderen besonders fetthaltigen Zubereitungen – als Emulgator einzusetzen. Eigelb besteht etwa zur Hälfte aus Wasser, zu 34 % aus Lipiden und zu 16 % aus Proteinen. Es bildet eine Emulsion von Fetttröpfchen in wässriger Proteinlösung, wobei die Tröpfchen hauptsächlich in zwei Arten vorkommen: der größere Teil des Fettes liegt in Form von Micellen vor, kleinen (⌀ 12–60 nm), typischen Lipoproteinstrukturen mit einem Kern aus Neutralfett und einer Membran aus Phospholipiden mit eingebetteten Proteinen und Cholesterin, die als LDL-Micellen (Low Density Lipoprotein) bezeichnet werden. Direkt im Plasma gelöst sind die sogenannten Livetine: wasserlösliche, langkettige, knäuelartig gefaltete (globuläre) Proteine.[5]
Die Livetine sind am wenigsten hitzebeständig. Beim Erwärmen einer Eigelblösung beginnen sie bereits bei ca. 65 °C zu denaturieren; dabei lockern und entfalten sich ihre Peptidketten und beginnen sich miteinander zu verbinden und ein Netzwerk auszubilden, wobei sie gegebenenfalls eingeschlagene Luftblasen stabilisieren. Gleichzeitig können sie verstärkt Wassermoleküle anlagern und dadurch Wasser binden, das Eigelb beginnt zu gelieren. Die Proteine der LDL-Micellen sind stabiler, die Emulsion bleibt daher erhalten. Erhöht man die Temperatur weiter, so werden die LDL-Micellen zerstört, die Emulsion bricht, die Zubereitung wird wieder dünnflüssiger; bei noch weiterer Temperaturerhöhung wird die Masse fest, das Eigelb gerinnt und flockt aus.[6]
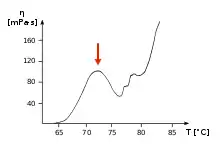
Das nebenstehende Bild zeigt die Veränderung der Viskosität (Dickflüssigkeit, bezeichnet mit dem griechischen Buchstaben η) einer Eigelblösung beim Erhitzen. Der „Punkt der Rose“, bis zu dem die Zubereitung abgebunden werden soll, ist durch einen Pfeil markiert; beim Abziehen zur Rose kommt es darauf an, dieses erste Viskositätsmaximum zu treffen. Würde man die Temperatur weiter erhöhen, so würde die Viskosität wieder abnehmen.
Das Diagramm zeigt jedoch nur einen möglichen Temperaturbereich. Die Temperatur, bei der das erste Viskositätsmaximum bei einem konkreten Rezept tatsächlich erreicht wird, hängt von den Zutaten ab, beispielsweise von Zucker- und Alkoholgehalt, Säuregrad und Verdünnung des Eigelbs. Zuckerzusatz verschiebt den „Punkt der Rose“ in höhere Temperaturbereiche, Alkoholzusatz in niedrigere.[6] Allgemein liegt die Zieltemperatur oberhalb von 65 °C; für süße Cremes wird angegeben, dass diese auf über 80 °C erhitzt werden müssen.[3]
Gibt man der Zubereitung Fett zu – wie etwa flüssige Butter, wenn man Buttersauce herstellt – dann vereinigen sich die LDL-Micellen mit den Fetttröpfchen, und zwar einschließlich der polaren Lipide, die sich anlagern. Die Proteine der LDL-Micellen entfalten sich, umlagern die Fetttröpfchen, treten in Wechselwirkung mit dem Livetinnetzwerk und stabilisieren damit die Emulsion.[6]
Anwendung
Eine zur Rose abgezogene Eigelbmasse ist die Grundlage für zahlreiche Süßspeisen, zum Beispiel Bayerische Creme, Englische Creme (Crème Anglaise) oder Cremeeis. Soßen, die zur Rose abgezogen werden, sind u. a. Holländische Soße (Sauce Hollandaise), Sauce béarnaise, Sauce mousseline und die klassisch mit Ei legierte Vanillesauce.
Bei Süßspeisen mit Milch wird zunächst das Eigelb mit dem Zucker schaumig gerührt, die erhitzte, aber nicht mehr kochende Milch unter ständigem Rühren und langsam beginnend hinzugefügt und schließlich die gesamte Masse zur Rose abgezogen, also vorsichtig erhitzt, bis sie spürbar eindickt. Auch Zabaglione ist eine Eigelbmasse, die erhitzt und eingedickt wird, enthält allerdings keine Milch und wird im Wasserbad zusätzlich schaumig geschlagen.
Eine zur Rose abgezogene Creme oder Soße darf nicht weiter erhitzt werden, andernfalls droht das Ei zu gerinnen, die Bindung der Masse lässt wieder nach, und es bilden sich griesartige Klümpchen. Daher wird oft mit einem Wasserbad gearbeitet. Dies dauert zwar länger, jedoch lässt sich die Energiezufuhr besser kontrollieren und die Masse kann nicht so leicht am Topfboden gerinnen oder gar anbrennen.
Einzelnachweise
- jonashaut: Zur Rose abziehen – Das Geheimnis von Milchspeiseeis. In: gutergeschmack.wordpress.com. 19. November 2012, abgerufen am 18. August 2015.
- F. Jürgen Herrmann: Das große Lexikon der Speisen. Pfanneberg, Haan-Gruiten 2012, ISBN 978-3-8057-0513-4, Stichwort Rose abziehen, S. 790.
- Günter Richter, Detlef Richter: Handbuch der Küche. Professionelle Arbeitsweisen, Organisation, gesetzliche Anforderungen. Matthaes, Stuttgart 2004, ISBN 3-87516-741-4, S. 92–93.
- Bitte, was heißt "bis zur Rose abziehen"? In: welt.de. 17. Februar 2007, abgerufen am 18. August 2015.
- Thomas Strixner, Ulrich Kulozik: Egg proteins. In: Glyn O. Phillips, Pete A. Williams (Hrsg.): Handbook of Food Proteins. Woodhead, Cambridge 2011, ISBN 978-0-85709-363-9, S. 168 ff. (eingeschränkte Vorschau in der Google-Buchsuche – Online-Ausgabe).
- Waldemar Ternes: Naturwissenschaftliche Grundlagen der Lebensmittelzubereitung. 3. überarbeitete Auflage. Behr, Hamburg 2008, ISBN 978-3-89947-422-0.