Zonisamid
Zonisamid ist ein Arzneistoff aus der Gruppe der Antikonvulsiva, der in der Zusatzbehandlung von partiellen epileptischen Krampfanfällen eingesetzt wird. Zonisamid wirkt über die Absenkung der Erregbarkeit von Nervenzellen. Als wirksamer Bestandteil eines Arzneimittel wurde Zonisamid erstmals 1989 durch Dainippon in Japan unter dem Namen Excegran in den Handel gebracht. Seit 2005 wird Zonisamid auch in der EU sowie in der Schweiz unter dem Handelsnamen Zonegran® vertrieben.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
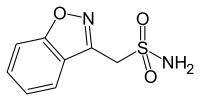 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Zonisamid | |||||||||||||||||||||
| Andere Namen |
1,2-Benzisoxazol-3-methansulfonamid | |||||||||||||||||||||
| Summenformel | C8H8N2O3S | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
N03AX15 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 212,2 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Klinische Angaben
Zugelassene Anwendungsgebiete
Zonisamid ist als Zusatztherapie für die Behandlung erwachsener Patienten mit partiellen (fokalen) Krampfanfällen mit oder ohne sekundäre Generalisierung in der EU und der Schweiz zugelassen.[2]
Art und Dauer der Anwendung
Entsprechend der Zulassung kann Zonisamid nur zusätzlich zu einer schon bestehenden Behandlung mit anderen Antikonvulsiva angewendet werden. Das Medikament wird oral aufgenommen.
Unerwünschte Wirkungen (Nebenwirkungen)
Am häufigsten treten psychische Nebenwirkungen auf (Erregbarkeit, Reizbarkeit, Verworrenheit, Depression). Weiterhin kommt es zu Erkrankungen des Nervensystems (Ataxie, Schwindel, Gedächtnisbeeinträchtigung, Schläfrigkeit), Diplopie und Anorexie. Zu den schwerwiegendsten beobachteten Nebenwirkungen zählten: allergische Reaktionen, Anfälle, malignes neuroleptisches Syndrom, Rhabdomyolyse und Nierensteine. Die sehr häufigen psychiatrischen und neurologischen Nebenwirkungen dürften den Einsatz von Zonisamid erschweren. Das häufige Vorkommen von allergischen Reaktionen und gelegentliche Auftreten von Nierensteinen steht mit den stofflichen Eigenschaften von Zonisamid in Verbindung (Sulfonamid, Carboanhydrasehemmer).
Wirkungsmechanismus
Der Wirkungsmechanismus von Zonisamid ist nicht vollständig geklärt. Es scheint auf spannungsabhängige Natrium- und Calciumkanäle zu wirken und damit die synchronisierte Entladung von Nervenzellen zu unterbrechen, wodurch die Verbreitung von Krampfentladungen reduziert wird. Zonisamid ist auch ein Carboanhydrasehemmer. Carboanhydrasehemmer führen zu einer Übersäuerung des Gewebes und reduzieren so auch die Erregbarkeit von Nervenzellen.
Chemische Informationen
Zonisamid ist ein Benzisoxazol-Derivat und Sulfonamid. Es weist kaum chemische Ähnlichkeiten mit anderen gebräuchlichen Antikonvulsiva auf, enthält aber wie Topiramat oder Sultiam eine Sulfonamidgruppe. Weitergehende strukturelle Ähnlichkeiten bestehen mit Benzisoxazolderivaten wie z. B. dem Neuroleptikum Risperidon.
Geschichtliches
Zonisamid wurde in den 1970er Jahren bei Dainippon synthetisiert und charakterisiert.[3] Die klinische Entwicklung wurde zunächst in Zusammenarbeit zwischen Dainippon und Parke-Davis (heute Teil von Pfizer) begonnen und führte 1989 zur Zulassung von Zonisamid in Japan (Excegran). Parke-Davis schied bereits 1987 aus der Zusammenarbeit aus. Hauptgrund für den Ausstieg von Parke-Davis war das häufige Auftreten von Nierensteinen. Dainippon führte die Entwicklung außerhalb Japans weiter und verkaufte 1997 die Rechte außerhalb Japans an Athena Neuroscience (heute Teil der Elan Corporation). Ein 1997 gestellter Zulassungsantrag in Europa wurde 1998 von Athena aufgrund von Mängeln in den Zulassungsunterlagen zurückgezogen. Im Jahre 2000 erfolgte die Zulassung in den USA. Élan übertrug 2004 die Rechte für Europa und die USA an Eisai. Die Zulassung in Europa erfolgte dann 2005, 16 Jahre nach der Erstzulassung in Japan.
Studien
Die europäische Zulassung beruht auf vier doppelblinden plazebokontrollierten Studien an etwa 500 Patienten, die Zonisamid über eine Dauer von bis zu 24 Wochen in ein- oder zweimal täglicher Gabe erhielten.[4] Diese Studien zeigen, dass mit einer anhaltenden Wirksamkeit bei Dosierungen von 300 bis 500 mg/Tag gerechnet werden kann. Weitere fünf offene Studien an etwa 700 Personen über einen Zeitraum von sieben Jahren belegen die langfristige Sicherheit.
Der Hersteller hat sich gegenüber der europäischen Zulassungsbehörde zur weiteren Untersuchung der neurologischen Wirkungen bei älteren Patienten sowie zu einem Entwicklungsprogramm für Kinder und Jugendliche verpflichtet.
Einzelnachweise
- Datenblatt Zonisamide sodium salt bei Sigma-Aldrich, abgerufen am 26. April 2011 (PDF).
- Europäischer öffentlicher Beurteilungsbericht Zonegran (EPAR). Europäische Arzneimittelagentur, abgerufen am 6. Januar 2016.
- Y. Masuda, Y. Utsui, Y. Shiraishi u. a.: Relationships between plasma concentrations of diphenylhydantoin, phenobarbital, carbamazepine, and 3-sulfamoylmethyl-1,2-benzisoxazole (AD-810), a new anticonvulsant agent, and their anticonvulsant or neurotoxic effects in experimental animals. In: Epilepsia. 20, 1979, S. 623–633. PMID 115675.
- M. J. Brodie, R. Duncan, H. Vespignani u. a.: Dose-dependent safety and efficacy of zonisamide: a randomized, double-blind, placebo-controlled study in patients with refractory partial seizures. In: Epilepsia. 46, 2005, S. 31–41. PMID 15660766.