Wolframhexacarbonyl
Wolframhexacarbonyl ist eine chemische Verbindung mit der Formel [W(CO)6]. Diese farblose Wolframverbindung ist wie ihre Chrom- und Wolfram-Analoga ein flüchtiger, relativ luftstabiler Komplex, in dem das Metall die Oxidationsstufe Null besitzt. Wolframhexacarbonyl wurde in Spurenkonzentrationen in den gasförmigen Ausdünstungen von Klärschlamm nachgewiesen.[6]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Wolframhexacarbonyl | |||||||||||||||
| Andere Namen |
Wolframcarbonyl | |||||||||||||||
| Summenformel | [W(CO)6] | |||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 351,90 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
2,65 g·cm−3[2] | |||||||||||||||
| Sublimationspunkt | ||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Darstellung
Wolframhexacarbonyl wird dargestellt durch die Reduktion von Wolframhexachlorid (WCl6) unter Kohlenstoffmonoxiddruck. Es wird allerdings selten auf diese Weise im Labor hergestellt, da die benötigten Gerätschaften kostspielig sind und die Verbindung kostengünstig erworben werden kann.
Es kann bei der reduktiven Carbonylierung auch Kupfer-Pulver oder Devarda-Legierung als Halogenid-Akzeptor anstelle von Triethylaluminium verwendet werden.[7]
Eigenschaften und Struktur

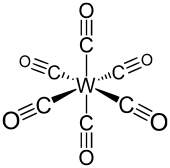
Wolframhexacarbonyl besitzt eine Oktaedergeometrie (Oh). Die sechs Kohlenstoffmonoxidliganden sind strahlenförmig um das zentrale Wolframatom positioniert. Das Dipolmoment des Komplexes beträgt 0 Debye. Der W-C-Abstand beträgt 207 pm.[1] Die Wellenzahl der C-O-Streckschwingung νCO des freien Kohlenstoffmonoxids liegt bei 1998 cm−1.[1] Es handelt sich um einen stabilen 18-Valenzelektronenkomplex.
Die Verbindung ist relativ luftstabil. Sie ist schwer löslich in unpolaren organischen Lösungsmitteln. Wie alle Metallcarbonyle ist Wolframhexacarbonyl bei unsachgemäßem Umgang eine gegebenenfalls gefährliche Quelle von flüchtigem Metall sowie Kohlenstoffmonoxid.
Reaktionen
Die Kohlenstoffmonoxidliganden im Wolframhexacarbonyl lassen sich durch andere Liganden substituieren. Es verhält sich ähnlich wie der analoge Molybdänkomplex, bildet jedoch in der Regel kinetisch stabilere Verbindungen.
Ein Derivat ist der Diwasserstoffkomplexes W(CO)3[P(C6H11)3]2(H2), der im Jahr 1982 von Kubas dargestellt wurde. Es handelt sich dabei um den ersten bekannten Diwasserstoffkomplex, dargestellt durch die Hiebersche Basenreaktion.[8]
Bis zu drei Kohlenstoffmonoxdliganden können durch Acetonitril ersetzt werden.[9]
Verwendung
Wolframhexacarbonyl wurde zur Entschwefelung von Organoschwefelverbindungen und als Vorstufe von Katalysatoren für die Alkenmetathese genutzt.
Wolframhexacarbonyl wird bei der Technik der Elektronenstrahl-induzierten Abscheidung als Precursor genutzt. Da es leicht verdampft und durch den Elektronenstrahl zerfällt, bietet es eine leicht zugängliche Quelle für Wolfram-Atome.
Einzelnachweise
- Christoph Elschenbroich: Organometallchemie, 6. Auflage, Teubner, Wiesbaden 2008, ISBN 978-3-8351-0167-8, S. 330.
- Datenblatt Tungsten hexacarbonyl, ≥99.9% trace metals basis, purified by sublimation bei Sigma-Aldrich, abgerufen am 23. Oktober 2011 (PDF).
- Eintrag zu Wolframhexacarbonyl. In: Römpp Online. Georg Thieme Verlag, abgerufen am 13. Dezember 2015.
- Eintrag zu Tungsten hexacarbonyl bei ChemBlink, abgerufen am 28. Dezember 2011.
- Eintrag zu Wolframhexacarbonyl in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- J. Feldmann: Determination of Ni(CO)4, Fe(CO)5, Mo(CO)6, and W(CO)6 in sewage gas by using cryotrapping gas chromatography inductively coupled plasma mass spectrometry. In: J Environ Monit, 1999, 1: S. 33–37, doi:10.1039/a807277i.
- Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1822.
- G. J. Kubas: Metal Dihydrogen and σ-Bond Complexes, Structure, Theory, and Reactivity; Kluwer Academic/Plenum Publishers: New York, 2001, 444 S., ISBN 978-0-306-46465-2.
- Gregory J. Kubas, Lori Stepan Van Der Sluys, Ruth Ann Doyle, Robert J. Angelici: Tricarbonyltris(Nitrile) Complexes of Cr, Mo, and W, Inorganic Syntheses, 1990, 28, S. 29–33, doi:10.1002/9780470132593.ch6.
