Voxelotor
Voxelotor ist ein Arzneistoff zur Behandlung einer Blutarmut (hämolytische Anämie) aufgrund von Sichelzellkrankheit. Unter dem Handelsnamen Oxbryta (Hersteller: Global Blood Therapeutics) wurde er im November 2019 in den USA und im Februar 2022 in der EU zugelassen. Voxelotor ist oral anwendbar.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
.svg.png.webp) | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Voxelotor[1] | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C19H19N3O3 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code |
B06AX03 | |||||||||||||||
| Wirkstoffklasse |
Hämatologika | |||||||||||||||
| Wirkmechanismus |
Polymerisationshemmung von HbS | |||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 337,37 g·mol−1 | |||||||||||||||
| Aggregatzustand |
Fest[2] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Hintergrund
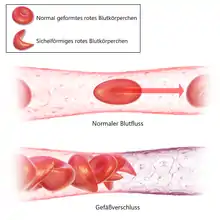
Die Sichelzellkrankheit ist eine genetisch bedingte Erkrankung, die eine Bildung von abnormalem Hämoglobin (Sichelzell-Hämoglobin, HbS) zur Folge hat, die eine Formänderung der roten Blutkörperchen (Erythrozyten) bewirkt. Sie nehmen eine sichelförmige Gestalt an („Sichelzellen“) und sind starr und klebrig, wodurch es zu Verklumpungen und zu einer Blockade des Blutstroms in den kleinen Gefäßen kommen kann. Es resultieren Episoden akut auftretender, schmerzhafter Durchblutungsstörungen (vasookklusive Krise; englisch: vaso-occlusive crisis, VOC; Sichelzellkrise) mit Folgeschäden für die Organe. Ferner kommt es zu einer hämolytischen Anämie, da die Sichelzellen rascher zerbersten und nicht die normale Lebensdauer roter Blutkörperchen erreichen.[4] Die Sichelzellkrankheit tritt überwiegend in der afrikanisch-stämmigen Bevölkerung auf. In den USA leben laut FDA 100.000 Menschen mit der Erkrankung, in Deutschland sind infolge der Migration etwa 3.000 Menschen von Sichelzell-Anämie betroffen.[5] Die Lebenserwartung ist um 30 Jahre vermindert.[5] Voxelotor unterdrückt die Polymerisation des Sichelzell-Hämoglobins und das Auftreten der hämolytischen Anämie.[4] Es ist der erste Wirkstoff mit diesem Wirkprinzip (First-in-class-Medikament).
Eigenschaften
Voxelotor ist eine weiße bis gelbliche bis beige, nicht hygroskopische Substanz. Sie ist in organischen Lösungsmitteln wie etwa Aceton und Toluol sehr gut löslich, in Wasser hingegen unlöslich.[3]
Pharmakologisch wirkt Voxelotor als Polymerisationsinhibtor für Hämoglobin S (HbS): In vitro wurde gezeigt, dass die niedermolekulare Verbindung an die N-terminale alpha-Kette des Hämoglobins bindet und dosisabhängig die HbS-Affinität für Sauerstoff erhöht. Die HbS-Polymerisation wird verzögert und die Sichelbildung der Erythrozyten verhindert. In einem Mausmodell für Sichelzellkranheit verlängerte Voxelotor die Halbwertszeit der Erythrozyten, verringerte die Anzahl der Retikulozyten und verhinderte ex vivo die Sichelbildung der Erythrozyten. Die Substanz verteilt sich bevorzugt in die Erythrozyten.[6] Nichtklinische Studien deuten auch darauf hin, dass Voxelotor die Verformbarkeit der Erythrozyten verbessern und die Viskosität des Vollbluts verringern kann.[3]
Zulassung
In den USA ist Voxelotor seit November 2019 für Patienten ab 12 Jahre,[7] seit Dezember 2021 auch für Kinder von 4 bis 11 Jahre zugelassen.[8] In der EU erstreckt sich die Zulassung auf Patienten ab 12 Jahren.[9] In den USA wurde die Zulassung in einem beschleunigten Verfahren (Accelerated Approval) erteilt,[7] in der EU wurde Oxbryta durch das Priority-Medicines-Programm (PRIME) der Europäischen Arzneimittelagentur (EMA) unterstützt.[4]
Zur Behandlung der hämolytischen Anämie aufgrund von Sichelzellkrankheit kann Voxelotor allein (als Monotherapie) oder in Kombination mit Hydroxycarbamid angewendet werden.[3]
Voxelotor hat in den USA und in der EU den Status als Orphan-Arzneimittel (Arzneimittel für seltene Krankheiten).[10][11]
Klinische Prüfung
Die Zulassung basiert auf Daten aus der Phase-3-Studie HOPE (Hemoglobin Oxygen Affinity Modulation to Inhibit HbS Polymerization) mit 274 Patienten ab zwölf Jahren mit Sichelzellkrankheit. Die Behandlung mit Voxelotor zeigte klinisch bedeutsame Verbesserungen des Hämoglobinspiegels (Hb) und eine Verringerung der Zerstörung der roten Blutkörperchen (Hämolyse). Nach 24 Behandlungswochen erreichten unter den Patienten, die Voxelotor erhielten, 51,1 % einen Hb-Anstieg von mehr als 1 g/100 mL gegenüber 6,5 % derjenigen, die ein Placebo erhielten. Es wurden signifikante Verbesserungen der Hämolyse-Marker „indirektes Bilirubin“ und „Retikulozytenanteil“ nachgewiesen.[12]
Eine weitere Analyse der HOPE-Studie über 72 Behandlungswochen zeigte zudem, dass Voxelotor auch über diesen Zeitraum eine Verbesserung der Hb-Werte und der Hämolyse-Marker bewirkt. Nach 72 Wochen erreichten 88,9 % der Patienten unter Voxelotor einen Anstieg des Hb-Wertes um mehr als 1 g/100 mL (vs. 25 % der Patienten in der Placebogruppe). Einen Anstieg um mehr als 2 g/100 mL nach 72 Wochen hatten 58,9 % in der Voxelotor-Gruppe (vs. 3,3 % in der Placebogruppe) und einen Anstieg um mehr als 3 g/100 mL hatten 20,0 % in der Voxelotor-Gruppe (vs. 0 % in der Placebogruppe). In der Voxelotor-Gruppe hatten die Patienten weniger Sichelzellkrisen.[13] Eine Analyse zum Auftreten von Beinulcera bei in der HOPE-Studie mit Voxletor behandelten Patienten ergab, dass sich die Beinulcera bei allen Patienten (5 von 5) unter Voxelotor verbesserten oder auflösten, im Vergleich zu 63 % der Patienten (5 von 8) in der Placebogruppe.[14]
Unerwünschte Wirkungen
Die häufigsten in der Studie beobachteten Nebenwirkungen waren Kopfschmerzen, Durchfall, Bauchschmerzen, Übelkeit, Müdigkeit, Hautausschlag und Fieber.[12]
Einzelnachweise
- INN Recommended List 78, World Health Organisation (WHO), 9. September 2016.
- GBT-440, caymanchem.com, abgerufen am 8. Februar 2022.
- Oxbryta Prescibing information, Stand Dezember 2021.
- New treatment for sickle cell disease, Europäische Arzneimittelagentur, 17. Dezember 2021.
- Neue Option bei Sichelzell-Anämie, pharmazeutische-zeitung.de, 28. November 2019.
- D. Oksenberg, K. Dufu, M.P. Patel et al.: GBT440 increases haemoglobin oxygen affinity, reduces sickling and prolongs RBC half-life in a murine model of sickle cell disease. British Journal of Hematology, Bd. 75, Nr. 1, 2016. S. 141–153, DOI:10.1111/bjh.14214.
- FDA approves novel treatment to target abnormality in sickle cell disease, FDA, 25. November 2019.
- FDA approves drug to treat sickle cell disease in patients aged 4 up to 11 years, FDA, 17. Dezember 2021.
- Eintrag EU/1/21/1622 im EU-Register für Humanarzneimittel, Europäische Kommission. Abgerufen am 25. Februar 2022.
- Eintrag EU/3/16/1769 im EU-Register für Orphan-Arzneimittel, Europäische Kommission. Abgerufen am 7. Februar 2022.
- Eintrag 499715 in der Datenbank Orphan Drug Designations and Approvals, FDA, abgerufen am 8. Februar 2022.
- E. Vichinsky, C.C. Hoppe, K.I. Ataga et al.: A Phase 3 Randomized Trial of Voxelotor in Sickle Cell Disease, New England Journal of Medicine, Bd. 381, 2019; S. 509–519, DOI:10.1056/NEJMoa1903212.
- J. Howard, K.I. Ataga, R.C. Brown et al.: Voxelotor in adolescents and adults with sickle cell disease (HOPE): long-term follow-up results of an international, randomised, double-blind, placebo-controlled, phase 3 trial. The Lancet Haematology, Bd. 8, Nr. 5, 2021. S. E323–E333, DOI:https://doi.org/10.1016/S2352-3026(21)00059-4.
- C.P. Minniti, J. Knight-Madden, M. Tonda, S. Gray, J. Lehrer-Graiwer, B.J. Biemond: The impact of voxelotor treatment on leg ulcers in patients with sickle cell disease. American Journal of Hematology, Bd. 96, Nr. 4, 2021. S. E126–E128, DOI:10.1002/ajh.26101.