Vanadylsulfat
Vanadylsulfat, VOSO4, ist eine anorganische Verbindung des Vanadiums.
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
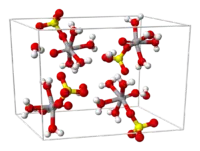 | |||||||||||||||||||
| Vanadylsulfat-Pentahydrat _ V _ S _ O | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Vanadylsulfat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Verhältnisformel |
| ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 163,00 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[2] | ||||||||||||||||||
| Dichte |
1,09 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Vorkommen
Wie die meisten wasserlöslichen Sulfate, findet man es sehr selten in der Natur. Die wasserfreie Form ist Pauflerit, ein Mineral fumarolen Ursprungs. Die Hydrate sind ebenfalls sehr selten; Hexahydrat (Stanleyit), Pentahydrate (Minasragrit, Orthominasragrit und Anorthominasragrit) und Trihydrat (Bobjonesit).
Darstellung
Die Darstellung von Vanadylsulfat erfolgt gewöhnlich durch die Reduktion von Vanadium(V)-oxid durch Schwefeldioxid[1]:
Die wasserfreie Verbindung ist erhältlich über mehrfaches mehrstündiges Kochen des Vanadium(V)-oxid in konzentrierter Schwefelsäure[1]:
Eigenschaften

Der stark hygroskopische, blaue Feststoff (Pentahydrat) ist eine der gebräuchlichsten Quellen von Vanadium im Labor. Es enthält das Vanadylion, VO2+, welches als das „stabilste zweiatomige Ion“ bezeichnet wurde.
In wässriger Lösung kristallisiert das Salz als Pentahydrat, das fünfte Wasser ist nicht an das Metall gebunden. Als Komplex gesehen, hat dieser eine oktaedrische Struktur, mit Sauerstoff, vier Wasser und einem Sulfat als Liganden. Die V=O-Bindungslänge beträgt 160 pm, sie ist somit 50 pm kürzer als die V–OH2-Bindungen. In Lösung dissoziiert das Sulfat-Ion sehr schnell.
Das Pentahydrat und das Trihydrat haben eine monokline Kristallstruktur mit der Raumgruppe P21/a (Raumgruppen-Nr. 14, Stellung 3).[3]
In saurer Lösung ergibt die Oxidation von Vanadylsulfat gelbfarbene Vanadyl(V)-Derivate. Eine Reduktion, z. B. durch Zink, ergibt Vanadium(III)- und Vanadium(II)-Derivate, welche charakteristisch grün und violett sind.
Verwendung
Zumeist ist Vanadylsulfat ein gebräuchliches Edukt für andere Vanadylderivate, wie Vanadium(IV)-oxy(acetylacetonat):
Vanadylsulfat ist ein Zwischenprodukt in der Extraktion von Vanadium aus Erdölresten, einer kommerziellen Hauptquelle von Vanadium.
Vanadylsulfat ist vor allem im Ausland, beispielsweise in den USA, in einigen Nahrungsergänzungsmitteln enthalten. Vor allem im Bereich des Bodybuildings werden hilfreiche Effekte von Vanadylsulfat beworben, ein belegbarer Effekt konnte jedoch nicht festgestellt werden.[4] Vanadylverbindungen sollen den Effekt von Insulin nachahmen, die Wirkungsweise wird ähnlich der von Chrompicolinat beschrieben.[5] In Deutschland ist Vanadylsulfat als Mineralstoff nicht zugelassen.[4]
Literatur
- Norman Neill Greenwood, Alan Earnshaw: Chemistry of the elements. Pergamon Press, Oxford 1984, ISBN 978-0-08-022056-7, S. 1157.
- Günter Bauer, Volker Güther, Hans Hess, Andreas Otto, Oskar Roidl, Heinz Roller, Siegfried Sattelberger: Vanadium and vanadium compounds. In: Ullman’s Encyclopedia of Industrial Chemistry. A27. Wiley-VCH, Weinheim 2002, S. 367–386 (gfe.com [PDF]).
- Burl E. Bryant, W. Conard Fernelius, Daryle H. Busch, R. Carl Stoufer, Wilmer Stratton: Vanadium(IV) Oxy(acetylacetonate). In: Inorganic Syntheses. 1957, S. 113–116, doi:10.1002/9780470132364.ch30.
Einzelnachweise
- Georg Brauer: Vandin(IV)-oxysulfat (Vanadylsulfat). In: Handbuch der Präparativen Anorganischen Chemie. Ferdinand Enke Verlag, Stuttgart 1954, S. 965–966.
- Eintrag zu Vanadium(IV)-oxidsulfat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- M. L. Smith, J. Marinenko: A reexamination of minasragrite. In: American Mineralogist. Band 58, 1973, S. 531–534 (minsocam.org [PDF]).
- Chemisches und Veterinäruntersuchungsamt Karlsruhe: Verbotene Stoffe in Nahrungsergänzungsmitteln (Memento vom 24. Oktober 2007 im Internet Archive)
- Pharmazeutische Zeitung online: Vorsicht vor der Prohormon-Falle, 10/2004.


