Trifluornitrosomethan
Trifluornitrosomethan (TFNM) ist ein hochreaktives giftiges Gas. Es ist bei Raumtemperatur intensiv blau.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
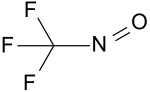 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Trifluornitrosomethan | |||||||||||||||
| Summenformel | CF3NO | |||||||||||||||
| Kurzbeschreibung |
intensiv blaues Gas[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 99,012 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||
| Siedepunkt |
−86,6 °C[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Geschichte
TFNM wurde 1936 erstmals von Otto Ruff und Manfred Giese an der Universität Breslau hergestellt.[3] Sie erhielten es bei der Fluorierung von Silbercyanid in Gegenwart von Silbernitrat und Silber(I)-oxid.
Eigenschaften

Trifluornitrosomethan hat eine – für Gase äußerst ungewöhnlich – intensiv blaue Farbe. Durch UV-Strahlung dimerisiert TFNM zum gasförmigen blassgelben 1,2-Bis(trifluormethyl)-diazen-1,2-dioxid.[4]
Der Bindungswinkel am Stickstoffatom des TFNM beträgt 112,4°.[5] Die Absorptionsmaxima liegen bei 665 und 683 nm.[1] Mit Wasserstoffperoxid oder molekularem Sauerstoff bei 100 °C lässt sich TFNM zum ebenfalls gasförmigen farblosen Trifluornitromethan oxidieren. Mit Aktivkohle oder im Alkalischen disproportioniert Trifluornitrosomethan zu Hexafluorazoxymethan und Trifluornitromethan.
An Doppelbindungen, beispielsweise perhalogenierter Alkene, addiert sich TFNM unter Bildung von hochmolekularen Polymeren.[6]
Herstellung
Trifluornitrosomethan lässt sich aus Trifluoriodmethan (CF3I) und Stickstoffmonoxid (NO) mit UV-Licht und katalytischen Mengen an Quecksilber herstellen. Bei Normaldruck beträgt die Ausbeute bis zu 90 %. Im Plasma lässt sich CF3NO auch aus Hexafluorethan oder Methylbromid und Stickstoffmonoxid herstellen.[7] Auch aus Nitrosylchlorid und Trifluoressigsäureanhydrid oder Silbertrifluoracetat lässt sich TFNM gewinnen. Dabei bildet sich zunächst CF3COONO, das beim Erhitzen in Kohlenstoffdioxid und TFNM zerfällt.[6][8][9]
Literatur
- Patent DE69420079T2: Mit organischen Aminen imprägnierte Aktivkohle. Angemeldet am 9. Juni 1994, veröffentlicht am 17. Februar 2000, Anmelder: The Minister of National Defence of Her Majesty's Canadian Government, Erfinder: Septimus Hsien-Chai Liang et al.
- J. S. Spasov und J. I. Cline: Scalar and angular correlations in CF3NO photodissociation: statistical and nonstatistical channels. In: Journal of Chemical Physics 110, 1999, S. 9568–9577.
- E. O. John u. a.: Difluorodinitrosomethane, ONCF2NO, and Hexafluorodinitrosopropane, ONCF2CF2CF2NO. In: Inorg Chem 31, 1992, S. 329–331, doi:10.1021/ic00028a040.
- R. C. White und L. J. Parcell: The Photolysis of Trifluoronitrosomethane. In: The Journal of Physical Chemistry 69, 1965, S. 4409–4410.
- J. E. Boggs u. a.: The Dipole Moment of Trifluoronitrosomethane. In: The Journal of Physical Chemistry 68, 1964, S. 2383–2384.
- M. I. Davis u. a.: An Electron Diffraction Study of Trifluoronitrosomethane. In: The Journal of Physical Chemistry 69, 1965, S. 3727–3730.
Weblinks
- Landolt-Börnstein (englisch)
Einzelnachweise
- J. Jander und R. N. Haszeldine: Über das CF3NO und einige seiner Reaktionen. In: Die Naturwissenschaften 40, 1953, S. 579–579. doi:10.1007/BF00594731.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- O. Ruff und M. Giese: Das Trifluor-nitroso-methan, CF3NO (III.) In: Ber dtsch Chem Ges 69, 1936, S. 684–689. doi:10.1002/cber.19360690411
- B. C. Haynie u. a.: Matrix Isolation and Density Functional Theory Study of Bis(trifluoromethyl)dioxodiazine: A Photodimer of Trifluoronitrosomethane. In: J Phys Chem A 109, 2005, S. 5307–5315. doi:10.1021/jp050730z
- K. Kuchitsu: CF3NO Trifluoronitrosomethane. In: Landolt-Börnstein - Group II Molecules and Radicals 25, 1999, S. 1615–1852. doi:10.1007/10653318_100
- A. Senning: N-, O-, and S-trihalomethyl compounds. In: Chemical Reviews 65, 1964, S. 385–412.
- M. Schmeisser u. a.: Die Plasmachemische Darstellung von Trifluorjodmethan, Bromtrifluormethan und Trifluornitrosomethan. In: Zeitschrift für anorganische und allgemeine Chemie 418, 1975, S. 109–115. doi:10.1002/zaac.19754180204
- C. W. Taylor u. a.: The Preparation of Polyfluoronitrosoalkanes from Nitrosyl Polyfluoroacylates. In: The Journal of organic chemistry 27, 1962, S. 1064–1066. doi:10.1021/jo01050a523
- J. D. Park u. a.: Preparation of Perfluoronitrosoalkanes. Reaction of Trifluoroacetic Anhydride with Nitrosyl Chloride. In: The Journal of organic chemistry 27, 1962, S. 1642. doi:10.1021/jo01051a519.