Trauermücken
Die Trauermücken (Sciaridae) sind eine Familie der Zweiflügler (Diptera) und gehören zur Unterordnung der Mücken (Nematocera). Weltweit sind etwa 1800 Arten beschrieben, was aber vermutlich nur ein Bruchteil der Gesamtartenzahl ist. In Europa sind mehr als 600 Arten bekannt. Ihren deutschen und wissenschaftlichen Namen verdanken sie der dunklen Körperfärbung und den dunkel getrübten Flügeln (gr. σκιαρός skiaros ‚beschattet‘, ‚dunkel‘).
| Trauermücken | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Eine Trauermücke | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Sciaridae | ||||||||||||
| Billberg, 1820 |
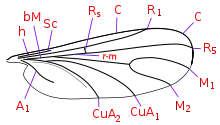
Merkmale
Die Mücken erreichen eine Körperlänge von einem bis sieben Millimetern. Sie haben einen schlanken Körper und sind dunkel gefärbt. Sie haben charakteristisch dunkle Flügel, auf denen die Mittelader sich glockenförmig aufteilt (s. Abb.). Die Weibchen einiger Arten sind dagegen flügellos. Wie die meisten Mücken haben sie lange Beine und 8- bis 16-gliedrige Fühler. Sie haben neben den Facettenaugen auch Punktaugen (Ocelli). Ihre Maxillarpalpen bestehen aus drei Segmenten. Der Thorax steht bei vielen Arten über den Kopf hinaus.
Die Larven haben einen schlanken Körperbau, sind gräulich weiß gefärbt und haben sehr kleine Tracheenöffnungen. Sie haben eine komplett ausgebildete, chitinisierte schwarze Kopfkapsel, sind also eucephal.
Verbreitung
Die Trauermücken sind weltweit verbreitet. Sie besiedeln auch extreme Lebensräume weit nördlich bzw. südlich der Polarkreise wie zum Beispiel Inseln um die Antarktis, Tundragebiete und auch Bergregionen über 4.000 m Seehöhe. Es gibt auch troglophil lebende Arten, die zum Teil sogar ausschließlich in Höhlen leben. Man findet sie aber auch in den heißen Gebieten der Erde. Arten der Gattung Parapnyxia graben sich sowohl während der heißen Stunden als auch in kalten Nächten im Wüstensand ein. Die meisten Arten findet man aber in feuchten Habitaten wie Wäldern, Mooren, Feuchtwiesen, auf Weiden, Feldern und auch in Gärten. Dort leben sie versteckt in Laub und Pflanzen. Sie treten auch in Häusern und Wohnungen auf und entwickeln sich dort in Blumentöpfen. In feuchten und schattigen Biotopen können die Trauermücken bis zu 70 % aller Zweiflüglerarten ausmachen.
Ihre Verbreitung wird entscheidend durch Wind und andere Verdriftung wie zum Beispiel auf Treibholz beeinflusst. Auch der Mensch trägt stark dazu bei. Durch den Handel mit landwirtschaftlichen Produkten und insbesondere den Transport von Humus, Blumenerde und Torf werden zahlreiche Arten eingeschleppt, die sich dauerhaft ansiedeln können. Dazu tragen auch die idealen Aufzuchtbedingungen biotopfremder Arten in Gewächshäusern bei, in denen für die Tiere optimale Temperatur- und Feuchtigkeitsbedingungen herrschen, Feinde dagegen fehlen.

Fossile Belege
Fossile Trauermücken sind aus verschiedenen Bernsteinvorkommen aus der Kreidezeit und dem Tertiär bekannt. Die ältesten Belege stammen aus dem unterkreidezeitlichen Libanon-Bernstein (etwa 130 Mio. Jahre); mit mindestens zehn Gattungen ist die Familie in Baltischem Bernstein (Eozän, ca. 40 bis 50 Mio. Jahre) am stärksten vertreten. Hier machen die Trauermücken etwa ein Fünftel aller in Baltischem Bernstein gefundenen Nematocera aus.[1][2] Die Trauermücken sind ein derart typisches und zentrales Element der bodennahen Fauna des eozän-oligozänen Bernsteinwaldes, dass diese von einigen Autoren als Sciara-Zone bezeichnet wird.[3]
Lebensweise
Die Imagines nehmen nur Flüssigkeiten auf und sterben schon ca. fünf Tage nach dem Schlupf. Sie leben nur, um sich zu paaren und fortzupflanzen. Charakteristisch ist ihr tänzelnder Flug.
Die Larven fressen saprophag oder mycetophag entweder organisches Material wie zum Beispiel Laub, Rinde und Totholz oder Pilze. Es gibt auch Arten, die in Pflanzenteilen und Wurzeln minieren. Die Larven zählen zu den wichtigsten Laub zersetzenden Organismen in Wäldern. Sie stellen auch ein wichtiges Glied in der Nahrungskette dar, sowohl für die Räuber, von denen sie gefressen werden, als auch für Mikroorganismen, die ihre Exkremente fressen.

Unter der Bezeichnung „Heerwurm“ (auch Ascarides militares, Haselwurm, Hungerwurm, Schlangenwurm, Wurmschlange, Dragfae, Orme-Drag, Gärds-Drag [= Hauszug], Härmask, Grynorm, Luskung [= Lauskönig], Armyworm, Kriegswurm, Kriegsschlange, Heerwürme, Heerschlange, Wurmdrache oder Drachenwurm) werden im Volksmund auffallende Ansammlungen von Trauermücken-Larven bezeichnet. Diese Züge können bis zu 14 Meter Länge erreichen und mehrere Hunderttausend Larven umfassen. Bei feuchter Witterung können sie etwa einen Meter pro Stunde zurücklegen. Heerwürmer wurden früher allein den Arten Sciara hemerobioides und Sciara militaris (die danach benannt wurde) zugeschrieben. Durch Zuchtversuche wurde aufgeklärt, dass auch zahlreiche andere Arten wie Sciara analis, Bradysia bicolor, Cratyna perplexa (syn. Sciara gregaria) und Ctenosciara hyalipennis solche Larvenzüge aufbauen können. Heerwürmer treten offensichtlich vor allem in Europa, fast nur in Mittel- und Nordeuropa auf, vor allem in den Mittelgebirgen. Die Gründe für die Massenvermehrung, die zu den Heerwurm-Zügen führen, sind nicht bekannt. Im Mittelalter wurden Heerwurm-Züge oft mit Krieg, Hungersnot, Krankheit und Tod in Verbindung gebracht.[4][5] Die erste dokumentierte Meldung von solchen Larvenzügen datiert aus dem Jahr 1603.

Da 90 Prozent der Larven Weibchen sind und die männlichen Imagines aufgrund ihrer Kurzlebigkeit und ihrer sehr begrenzten Flugkünste nur geringe Entfernungen überwinden können, ist die Partnerfindung nur dann gewährleistet, wenn die Larven im Verbund bleiben. Der hohe Anteil weiblicher Tiere bewirkt ein weit höheres Vermehrungspotential gegenüber Arten mit ausgeglichenem Geschlechterverhältnis. In Anbetracht der geringen Mobilität der Imagines dient der gemeinsame Larvenzug auch der Ausbreitung.
Entwicklung
Die Weibchen legen bis zu 200 durchsichtige Eier in den feuchten Erdboden. Nach ca. sieben bis acht Tagen schlüpfen die Larven. Diese leben in großen Gruppen von bis zu 2.500 Tieren pro Quadratmeter. Die Larvenzüge kann man in Mitteleuropa von Mai bis Juni beobachten. Die Verpuppung, die in einer Mumienpuppe stattfindet, erfolgt im Juli und August.
Genetik
Die Genetik der Trauermücken weist einige Besonderheiten auf, die größtenteils schon in den 1920er- und 1930er-Jahren von Charles W. Metz und Mitarbeitern in den USA erforscht wurden.[6][7]
Die Männchen der Trauermücken geben – wie auch bei den verwandten Gallmücken – nur diejenigen Erbanlagen an ihre Nachkommen weiter, die sie von ihrer Mutter erhalten hatten. Während das weibliche Geschlecht sich ganz normal fortpflanzt und eine kontinuierliche Kette von Vorfahren und Nachkommen bildet, fungieren die Männchen also nur als Vermittler zwischen diesen rein weiblichen Vererbungslinien. Zytologisch basiert das auf einem besonderen Ablauf der Spermatogenese: Bei der Meiose I paaren sich die homologen Chromosomen nicht (wie es der Regelfall ist), sondern treten ohne vorherige Paarung auseinander. Ungewöhnlich ist dabei auch der Bau des Spindelapparats: Es ist nur eine Halbspindel mit einem Pol vorhanden, zu welchem die maternalen Chromosomen (das heißt diejenigen mütterlichen Ursprungs) gezogen werden. Die paternalen Chromosomen (väterlichen Ursprungs) hingegen bewegen sich in entgegengesetzter Richtung zur Zellperipherie und werden dort in einer kleinen Plasmaknospe abgeschnürt, welche zugrunde geht.
Diese Trennung der homologen Chromosomen ohne vorherige Paarung ist möglich, weil die beiden Chromosomensätze schon vor der Kernteilung im noch intakten Zellkern nicht (wie sonst üblich) miteinander vermengt sind. Stattdessen sind die vier Chromosomen eines jeden Satzes ringförmig angeordnet, und beide Ringe liegen etwa parallel nebeneinander.[8] Während bei dem gewöhnlichen Ablauf der ersten meiotischen Teilung homologe Chromosomen nach der Paarung zufällig auf beide Tochterkerne verteilt werden (ein wesentlicher Aspekt der genetischen Rekombination), sind sie hier also schon vor der Meiose nach ihrer Herkunft separiert.
Ungewöhnlich ist auch der Ablauf der zweiten meiotischen Teilung. Bei dieser versammelt sich das X-Chromosom (das einzige bei den Männchen vorhandene Geschlechtschromosom) nicht mit den übrigen Chromosomen (Autosomen) in der Metaphaseplatte zwischen den Spindelpolen, um dort geteilt zu werden, sondern begibt sich schon vorzeitig zu einem Pol und teilt sich erst dort oder auf dem Weg dorthin.[6][7][9] Da auch hier (wie schon nach der Meiose I) eine hochgradig inäquale Zellteilung folgt und nur aus demjenigen Tochtergebilde, welches das letztlich doppelt vorhandene X-Chromosom erhalten hat, ein Spermium hervorgeht, enthalten also alle Spermien zwei X-Chromosomen. Nach der Befruchtung sind daher in der Zygote drei X-Chromosomen vorhanden.
Die Bestimmung des Geschlechts der Trauermücken erfolgt ebenfalls auf außergewöhnliche Weise. Wie bei vielen anderen Insekten liegt im Prinzip der X0-Typ der Geschlechtsbestimmung vor, das heißt Weibchen besitzen zwei X-Chromosomen, Männchen nur eines. Die Anzahl der X-Chromosomen wird hier jedoch nicht (wie im Normalfall) durch die Chromosomen-Ausstattung der Keimzellen bestimmt, denn die Zygote enthält aus den zuvor genannten Gründen immer drei X-Chromosomen. In einem frühen Embryonalstadium (zumeist bei der 7. Furchungsteilung) werden ein oder zwei X-Chromosomen eliminiert, indem sie sich bei der Mitose nicht teilen und in der Metaphaseplatte zurückbleiben. Wie viele X-Chromosomen eliminiert werden, hängt vom Erbgut der Mutter ab; daher bekommt jedes Trauermücken-Weibchen entweder nur weibliche oder nur männliche Nachkommen.[6][7][10][11]
Eine weitere Besonderheit ist das Vorhandensein spezieller Chromosomen nur in der Keimbahn, also in Keimzellen und deren potentiellen Vorgängern (allerdings nicht bei allen Arten der Trauermücken). Sie werden als Keimbahn-begrenzte Chromosomen, engl. germ line limited chromosomes oder davon abgeleitet L-Chromosomen bezeichnet. Bei den meiotischen Teilungen im Zuge der Spermatogenese werden sie ebenfalls nicht zufällig verteilt, sondern gelangen unreduziert alle in das einzige Spermium. Ähnlich wie die zuvor erwähnten überzähligen X-Chromosomen werden jedoch alle bis auf exakt zwei L-Chromosomen in einem frühen Embryonalstadium der Nachkommen aus den Zellkernen ausgeschieden.[12] Beim Übergang von der Keimbahn zum Soma werden sie komplett eliminiert, in den Keimbahn-Zellen sind sie jedoch unentbehrlich: Gehen sie verloren, dann bleiben diese Zellen in der Entwicklung zurück und treten nicht in die Meiose ein.[12]
Arten (Auswahl)
Schadwirkung und Bekämpfung
Einige Trauermückenarten können bei Massenauftreten Schäden in der Landwirtschaft anrichten. Befallen werden neben verschiedenen Gemüsesorten und Champignons auch Zierpflanzen, sowohl im Gewächshaus als auch im Freiland. Es kommt zu Fraßschäden an Wurzeln und anderen Pflanzenteilen durch die Larven. Keimlinge und Jungpflanzen können dadurch absterben.
Während man früher zu synthetischen Insektiziden (zum Beispiel Dimethoat, im Handel als Bi-58) gegriffen hat, um der Plage Herr zu werden, gibt es heute biologische Mittel, die ähnlich gut wirken und, anders als die chemischen Präparate, auch Jungpflanzen nicht beeinträchtigen. Zu diesen Mitteln zählen Steinernema-feltiae-Nematoden (SF-Nematoden) und Bacillus thuringiensis israelensis (BTI). In das Substrat gegossen, bekämpfen sie die Mücken auf unterschiedliche Weise: Während die Nematoden aktiv nach den Larven suchen, müssen die Larven die BTI erst fressen. Dementsprechend ist ersteres Mittel besser bei starkem Befall und zweiteres zur Vorbeugung.
Gelbtafeln werden häufig gegen Trauermücken angeboten, dienen aber nur bedingt zur Bekämpfung, da sie nur die kurzlebigen Imagines reduzieren und die Larven dabei ungestört lassen.
Weblinks
- Fam. Sciaridae Trauermücken (Memento vom 5. Juli 2008 im Internet Archive)
- Trauermücken als Schädlinge an Zimmerpflanzen
Einzelnachweise
- George O. Poinar, Jr.: Life in Amber. 350 S., 147 Fig., 10 Tafeln, Stanford University Press, Stanford (Cal.) 1992. ISBN 0-8047-2001-0
- Wolfgang Weitschat und Wilfried Wichard: Atlas der Pflanzen und Tiere im Baltischen Bernstein, 256 S., zahlr. Abb., Pfeil-Verlag, München 1998. ISBN 3-931516-45-8
- Sven Gisle Larsson: Baltic Amber – a Palaeobiological Study. Klampenborg (DK) 1978. ISBN 87-87491-16-8.
- Frank Menzel (1999): Revision der paläarktischen Trauermücken (Diptera, Sciaridae) unter besonderer Berücksichtigung der deutschen Fauna. Dissertation, Fachbereich Umweltwissenschaften der Universität Lüneburg. darin Kap. 4.2: Das Phänomen des Heerwurms.
- Frank Menzel & Ulrich Schulz (2007): Die Trauermücken in Deutschland – ökosystemare Bedeutung, zönologische Koinzidenzen und bioindikatorisches Potential. Beiträge zur Entomologie 57 (1): 9–36 doi:10.21248/contrib.entomol.57.1.9-36.
- C. W. Metz, Chromosome behavior, inheritance and sex determination in Sciara. In: American Naturalist. Band 72, 1938, JSTOR 2457532, S. 485–520
- S. A. Gerbi: Germ Line — Soma Differentiation. Hrsg.: Wolfgang Hennig. Band 13. Springer, Berlin, Heidelberg 1986, ISBN 978-3-662-21958-4, Kapitel Unusual Chromosome Movements in Sciarid Flies, S. 71–104, doi:10.1007/978-3-540-39838-7_2.
- D. F. Kubai: Nonrandom chromosome arrangements in germ line nuclei of Sciara coprophila males: the basis for nonrandom chromosome segregation on the meiosis I spindle. In: The Journal of Cell Biology. Band 105, Nr. 6, Dezember 1987, S. 2433–2446, doi:10.1083/jcb.105.6.2433.
- Melvin L. Zilz: In vitro male meiosis in the fungus gnat (Sciara), with analysis of chromosome movements during anaphase I and II. Detroit, MI 1970, OCLC 16865909 (Dissertation).
- Clara Goday, M. Rosario Esteban: Chromosome elimination in sciarid flies. In: BioEssays. Band 23, Nr. 3, März 2001, ISSN 1521-1878, S. 242–250, doi:10.1002/1521-1878(200103)23:33.0.CO;2-P.
- B. de Saint Phalle, W. Sullivan: Incomplete sister chromatid separation is the mechanism of programmed chromosome elimination during early Sciara coprophila embryogenesis. In: Development. Band 122, Nr. 12, Dezember 1996, ISSN 1477-9129, S. 3775–3784 (Abstract).
- Sally M. Rieffel, Helen V. Crouse: The elimination and differentiation of chromosomes in the germ line of sciara. In: Chromosoma. Band 19, Nr. 3, September 1966, ISSN 1432-0886, S. 231–276, doi:10.1007/BF00326917.